よむ、つかう、まなぶ。
資料1-6-2 「ニトロソアミン類の混入リスクに関する自主点検に基づくリスク管理措置に係る薬事手続について」に関する質疑応答集(Q&A)について[137KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3
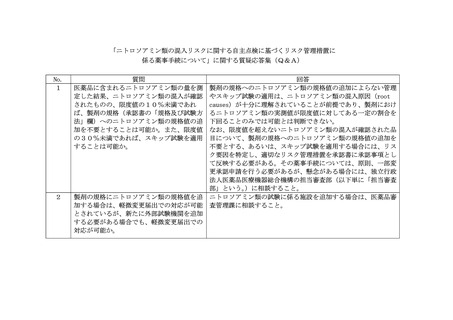
リスク管理措置の一つとして、原薬の規格に
ニトロソアミン類の規格値を追加することも
考えられるが、この場合はどのように対応す
べきか。
4
製剤の規格にニトロソアミン類の規格値を追
加しない場合であっても、安定性モニタリン
グにおいて経時的なニトロソアミン類の変動
を測定すべきか。
5
日局品の添加剤に亜硝酸含量の規格値を追加
する場合、「成分及び分量又は本質」欄に記
載する規格は「日局」ではなく、「別紙規
格」となるか。
本通知で求められているニトロソアミン類のリスク管理措置は、
原薬の管理のみならず、添加剤の管理や、製剤の製造工程中や保
管中にニトロソアミン類が生成・増加しないことなど、市場に出
荷される製剤の全ての側面におけるリスク管理措置である。その
上で、質問のように原薬に関する管理や薬事手続に絞ってその妥
当性を確認したい場合には、担当審査部に相談すること(後発医
薬品MF確認相談等)。
製剤の規格にニトロソアミン類の規格値を追加しない場合であっ
ても、少なくともニトロソアミン類の混入が確認された品目につ
いては、安定性モニタリングにおいて経時的なニトロソアミン類
の変動を測定し、有効期間を通じて限度値を超えないことを確認
すべきである。
「成分及び分量又は本質」欄の規格には「日局」と記載し、テキ
スト欄に「なお、○○(成分名)の亜硝酸含量の規格及び試験方
法は別紙規格に記載する。」と記載すること。
「別紙規格」欄には以下の例を参考に亜硝酸含量の規格及び試験
方法を記載すること。
【別紙規格】
【名称】
:○○
・・・・・・・・・・・・・・・・・・・・・・・・・・・・・
【規格及び試験方法】
【試験名】
:日本薬局方
【規格及び試験方法】 日本薬局方「○○」によるほか、以下の
とおり。
【規格及び試験方法】
【試験名】
:亜硝酸
【規格及び試験方法】 ・・・(以下、規格及び試験方法の内容
リスク管理措置の一つとして、原薬の規格に
ニトロソアミン類の規格値を追加することも
考えられるが、この場合はどのように対応す
べきか。
4
製剤の規格にニトロソアミン類の規格値を追
加しない場合であっても、安定性モニタリン
グにおいて経時的なニトロソアミン類の変動
を測定すべきか。
5
日局品の添加剤に亜硝酸含量の規格値を追加
する場合、「成分及び分量又は本質」欄に記
載する規格は「日局」ではなく、「別紙規
格」となるか。
本通知で求められているニトロソアミン類のリスク管理措置は、
原薬の管理のみならず、添加剤の管理や、製剤の製造工程中や保
管中にニトロソアミン類が生成・増加しないことなど、市場に出
荷される製剤の全ての側面におけるリスク管理措置である。その
上で、質問のように原薬に関する管理や薬事手続に絞ってその妥
当性を確認したい場合には、担当審査部に相談すること(後発医
薬品MF確認相談等)。
製剤の規格にニトロソアミン類の規格値を追加しない場合であっ
ても、少なくともニトロソアミン類の混入が確認された品目につ
いては、安定性モニタリングにおいて経時的なニトロソアミン類
の変動を測定し、有効期間を通じて限度値を超えないことを確認
すべきである。
「成分及び分量又は本質」欄の規格には「日局」と記載し、テキ
スト欄に「なお、○○(成分名)の亜硝酸含量の規格及び試験方
法は別紙規格に記載する。」と記載すること。
「別紙規格」欄には以下の例を参考に亜硝酸含量の規格及び試験
方法を記載すること。
【別紙規格】
【名称】
:○○
・・・・・・・・・・・・・・・・・・・・・・・・・・・・・
【規格及び試験方法】
【試験名】
:日本薬局方
【規格及び試験方法】 日本薬局方「○○」によるほか、以下の
とおり。
【規格及び試験方法】
【試験名】
:亜硝酸
【規格及び試験方法】 ・・・(以下、規格及び試験方法の内容