よむ、つかう、まなぶ。
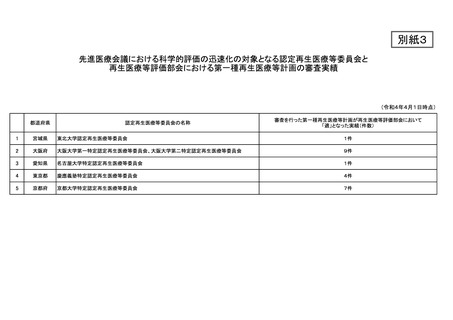
資料8 再生医療等安全性確保法が適用される先進医療B医療技術に係る審査過程の迅速化について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(以下参考)
「厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き等の取扱いにつ
いて(平成 28 年3月4日
医政研発 0304 第1号、薬生審査発 0304 第2号、薬生機発
0304 第2号、保医発 0304 第 17 号)最終改正令和4年3月 25 日
※一部抜粋
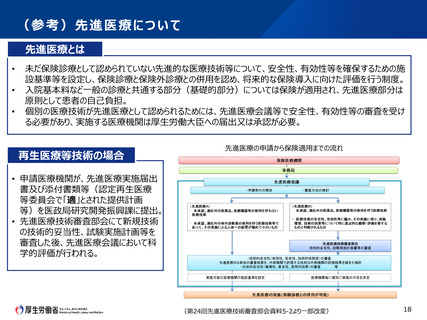
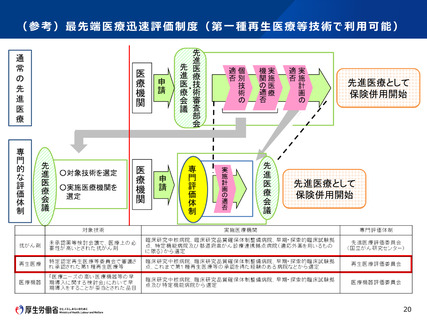
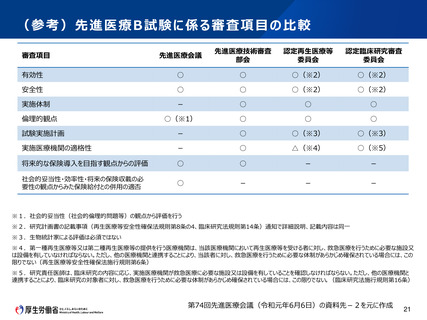
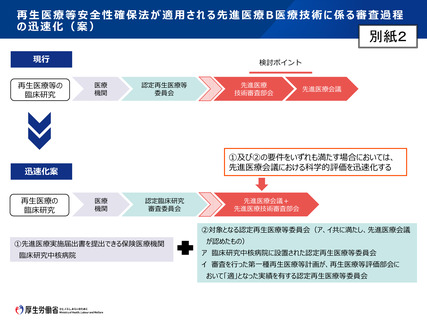
第2 先進医療Bについて
7
認定臨床研究審査委員会で承認された先進医療Bに係る新規技術の審査等
臨床研究法に規定する臨床研究として認定臨床研究審査委員会で承認された先
進医療Bに係る審査を行う場合であって、次の①及び②の要件をいずれも満たす場
合においては、先進医療会議における科学的評価の迅速化を実施する。
①
先進医療実施届出書を提出できる保険医療機関
先進医療会議における科学的評価の迅速化の対象となる先進医療の届出を提
出できる保険医療機関は、以下のアからウのいずれかとする。
ア
臨床研究中核病院
イ
特定機能病院
ウ
高度専門医療に関する研究等を行う国立研究開発法人に関する法律(平成 29
年法律第 93 号)第2条に規定する国立研究開発法人に設置された保険医療機
関
②
対象となる認定臨床研究審査委員会
先進医療会議における科学的評価の迅速化の対象となる認定臨床研究審査委
員会は、以下のア又はイのうち、先進医療会議が認めたものとする。
ア
臨床研究中核病院に設置された認定臨床研究審査委員会(大学設置基準(昭
和 31 年文部省令第 28 号)第 39 条に定める附属病院の場合は、当該大学に設
置された認定臨床研究審査委員会を含む。
)
イ
審査を行った臨床研究が先進医療Bとして「適」となり、かつ、審査を行っ
た当該臨床研究の主要評価項目報告書又は総括報告書及びその概要が部会及
び先進医療会議で評価された実績を有する認定臨床研究審査委員会(※)
※
ただし、これを満たさない場合であっても、審査を行った臨床研究が先進
医療Bとして「適」となった実績を有する認定臨床研究審査委員会について
は、先進医療会議が認めた場合は本対象とすることとする。
「厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き等の取扱いにつ
いて(平成 28 年3月4日
医政研発 0304 第1号、薬生審査発 0304 第2号、薬生機発
0304 第2号、保医発 0304 第 17 号)最終改正令和4年3月 25 日
※一部抜粋
第2 先進医療Bについて
7
認定臨床研究審査委員会で承認された先進医療Bに係る新規技術の審査等
臨床研究法に規定する臨床研究として認定臨床研究審査委員会で承認された先
進医療Bに係る審査を行う場合であって、次の①及び②の要件をいずれも満たす場
合においては、先進医療会議における科学的評価の迅速化を実施する。
①
先進医療実施届出書を提出できる保険医療機関
先進医療会議における科学的評価の迅速化の対象となる先進医療の届出を提
出できる保険医療機関は、以下のアからウのいずれかとする。
ア
臨床研究中核病院
イ
特定機能病院
ウ
高度専門医療に関する研究等を行う国立研究開発法人に関する法律(平成 29
年法律第 93 号)第2条に規定する国立研究開発法人に設置された保険医療機
関
②
対象となる認定臨床研究審査委員会
先進医療会議における科学的評価の迅速化の対象となる認定臨床研究審査委
員会は、以下のア又はイのうち、先進医療会議が認めたものとする。
ア
臨床研究中核病院に設置された認定臨床研究審査委員会(大学設置基準(昭
和 31 年文部省令第 28 号)第 39 条に定める附属病院の場合は、当該大学に設
置された認定臨床研究審査委員会を含む。
)
イ
審査を行った臨床研究が先進医療Bとして「適」となり、かつ、審査を行っ
た当該臨床研究の主要評価項目報告書又は総括報告書及びその概要が部会及
び先進医療会議で評価された実績を有する認定臨床研究審査委員会(※)
※
ただし、これを満たさない場合であっても、審査を行った臨床研究が先進
医療Bとして「適」となった実績を有する認定臨床研究審査委員会について
は、先進医療会議が認めた場合は本対象とすることとする。