よむ、つかう、まなぶ。
参考資料2 新型コロナワクチン「コミナティRTU筋注(2価:起源株/オミクロン株BA.1)」(ファイザー株式会社)添付文書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
本剤接種群のSARS-CoV-2感染歴がない178例及びコミナティ筋注
(起
源株)接種群のSARS-CoV-2感染歴がない163例を対象に、接種後1ヵ
月のSARS-CoV-2オミクロン株BA.1血清中和抗体価及び抗体応答率を
評価した結果、表1及び表2のとおり本剤接種群のコミナティ筋注(起
源株)接種群に対する優越性及び非劣性がそれぞれ示された。
(1)16歳以上の参加者
36523例(コミナティ筋注(起源株)接種群:18198例、プラセボ接
種群:18325例)を対象に、1つ目の主要有効性評価項目である「SARSCoV-2感染歴がない参加者での2回目接種後7日以降のSARS-CoV-2に
よる感染症に対するコミナティ筋注(起源株)の有効性[ワクチン
有効性1(VE1)
]
」を評価した。40137例(コミナティ筋注(起源株)
接種群:19965例、プラセボ接種群:20172例)を対象に、2つ目の主
要有効性評価項目である「SARS-CoV-2感染歴の有無を問わない参加
者での2回目接種後7日以降のSARS-CoV-2による感染症に対するコミ
ナティ筋注(起源株)の有効性(VE2)」を評価した。解析結果は表
4のとおりであった4)。
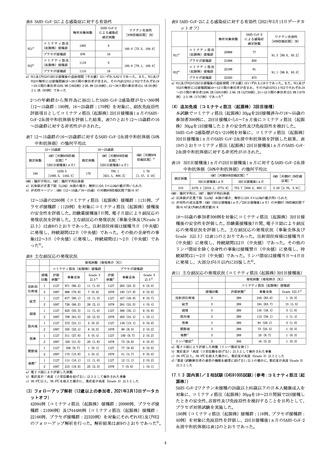
表1 本剤接種群のコミナティ筋注(起源株)接種群に対するSARS-CoV2オミクロン株BA.1血清中和抗体価(50%中和抗体価)の幾何平均
比
本剤接種群
コミナティ筋注(起源株)接種群
測定例数
GMT[両側95%信頼
区間]a)
(接種後1ヵ月)
測定例数
GMT[両側95%信頼
区間]a)
(接種後1ヵ月)
178
711.0
[588.3, 859.2]
163
455.8
[365.9, 567.6]
GMR
[両側95%信頼
区間]b)
表4 SARS-CoV-2による感染症に対する有効性
1.56
[1.17, 2.08]
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)優越性基準:GMR(本剤/コミナティ筋注(起源株))の両側95%信頼区間下限>1
VE1a)
表2 本剤接種群のコミナティ筋注(起源株)接種群に対するSARS-CoV2オミクロン株BA.1血清中和抗体応答率の差
本剤接種群
VE2a)
コミナティ筋注(起源株)接種群
測定例数
na)(抗体応答率[%])
[両側95%信頼区間]
(接種後1ヵ月)
測定例数
169
121(71.6)
[64.2, 78.3]
149
差(%)
na)(抗体応答率[%]) [両側95%信頼区
[両側95%信頼区間]
間]b)
(接種後1ヵ月)
85(57.0)
[48.7, 65.1]
解析対象例数
SARS-CoV-2
による感染症
確定例数
コミナティ筋注
(起源株)接種群
18198
8
プラセボ接種群
18325
162
コミナティ筋注
(起源株)接種群
19965
9
プラセボ接種群
20172
169
ワクチン有効性
[95%信用区間](%)
95.0[90.3, 97.6]
94.6[89.9, 97.3]
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はそれぞれ57日と55日であった。また、VE1
及びVE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2でそれぞ
れ19~23日間の参加者は96.5%(35248例)と96.3%(38665例)、24~42日間の参加者は3.5%
(1275例)と3.7%(1472例)であった5)
14.6
[4.0, 24.9]
16歳以上の43448例(コミナティ筋注(起源株)接種群:21720例、プ
ラセボ接種群:21728例)を対象にコミナティ筋注(起源株)接種後の
安全性を評価した。一部の参加者(解析対象例数:1回目接種後8183
例、2回目接種後7507例)で治験薬接種後7日間、電子日誌により副反
応の発現状況を評価した。主な副反応の発現状況(事象全体及びGrade
3以上)は表5のとおりであった4)。注射部位疼痛は接種当日(中央値)
に発現し、持続期間は2日(中央値)であった。その他の全身性の事象
は接種翌日(中央値)に発現し、持続期間は1日(中央値)であった5)。
a)抗体価が本剤接種前(SARS-CoV-2ワクチンとして4回目接種前)のベースライン値(ベース
ライン値が定量下限(LLOQ)未満の場合はLLOQ値)から4倍以上上昇した治験参加者数
b)非劣性マージン:抗体応答率の差(本剤 - コミナティ筋注(起源株))の両側95%信頼区
間下限>-5%
305例を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、
電子日誌により副反応の発現状況を評価した。主な副反応の発現状
況(事象全体及びGrade 3以上)は表3のとおりであった。注射部位
疼痛は接種翌日(中央値)に発現し、持続期間は2日(中央値)であ
った。その他の全身性の事象は接種翌日(中央値)に発現し、持続
期間は1~2日(中央値)であった3)。
表5 主な副反応の発現状況
発現例数(発現割合[%])
表3 主な副反応の発現状況
コミナティ筋注(起源株)接種群
発現例数(発現割合[%])
本剤接種群
接種
回数a)
評価
例数b)
事象全体
コミナティ筋注(起源株)接種群
Grade 3
以上c)
評価
例数b)
事象全体
Grade 3
以上c)
注射部
位疼痛
1
301
175(58.1)
1(0.3)
298
179(60.1)
1(0.3)
疲労
1
301
148(49.2)
5(1.7)
298
135(45.3)
1(0.3)
頭痛
1
301
101(33.6)
1(0.3)
298
79(26.5)
1(0.3)
筋肉痛
1
301
67(22.3)
0(―)
298
59(19.8)
0(―)
悪寒
1
301
39(13.0)
0(―)
298
49(16.4)
0(―)
関節痛
1
301
34(11.3)
0(―)
298
27(9.1)
0(―)
d)
1
301
15(5.0)
4(1.3)
298
11(3.7)
0(―)
発熱
注射部
位疼痛
疲労
頭痛
筋肉痛
悪寒
a)SARS-CoV-2ワクチンとして4回目接種
b)電子日誌により評価した例数
c)重症度が「高度(日常活動を妨げる)」以上として報告された事象
d)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
関節痛
発熱c)
17.1.2 海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)第Ⅱ/Ⅲ相パート
(参考:コミナティ筋注(起源株)
)
SARS-CoV-2ワクチン未接種の12歳以上の健康な参加者を対象に、コ
ミナティ筋注(起源株)30µgを19~23日間隔で2回接種したときの有
効性及び安全性を検討することを目的として、プラセボ対照無作為
化多施設共同試験を実施した。さらに、本試験でコミナティ筋注(起
源株)30µgを2回接種済みの18~55歳の参加者にコミナティ筋注(起
源株)30µgを1回接種したときの免疫原性及び安全性も検討した。
接種
回数
評価
例数a)
1
2
プラセボ接種群
事象全体
Grade 3
以上b)
評価
例数a)
事象全体
Grade 3
以上b)
4093
3186(77.8)
28(0.7)
4090
488(11.9)
2(0.0)
3758
2730(72.6)
33(0.9)
3749
372(9.9)
0(-)
1
4093
1700(41.5)
35(0.9)
4090
1172(28.7)
14(0.3)
2
3758
2086(55.5) 143(3.8)
3749
756(20.2)
16(0.4)
1
4093
1413(34.5)
25(0.6)
4090
1100(26.9)
22(0.5)
2
3758
1732(46.1)
76(2.0)
3749
735(19.6)
19(0.5)
1
4093
738(18.0)
14(0.3)
4090
398(9.7)
5(0.1)
2
3758
1260(33.5)
63(1.7)
3749
260(6.9)
4(0.1)
1
4093
434(10.6)
9(0.2)
4090
203(5.0)
3(0.1)
2
3758
1114(29.6)
62(1.6)
3749
125(3.3)
0(-)
1
4093
406(9.9)
7(0.2)
4090
247(6.0)
1(0.0)
2
3758
772(20.5)
27(0.7)
3749
170(4.5)
5(0.1)
1
4093
111(2.7)
8(0.2)
4090
27(0.7)
7(0.2)
2
3758
512(13.6)
32(0.9)
3749
14(0.4)
3(0.1)
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
(2)12~15歳の参加者
12~15歳の参加者における有効性を追加で評価した。1983例(コミ
ナティ筋注(起源株)接種群:1005例、プラセボ接種群:978例)を
対象に「SARS-CoV-2感染歴がない参加者での2回目接種後7日以降の
SARS-CoV-2による感染症に対するコミナティ筋注(起源株)の有効
性[ワクチン有効性1(VE1)
]
」を、2229例(コミナティ筋注(起源
株)接種群:1119例、プラセボ接種群:1110例)を対象に「SARS-CoV2感染歴の有無を問わない参加者での2回目接種後7日以降のSARSCoV-2による感染症に対するコミナティ筋注(起源株)の有効性
(VE2)」
を評価した。解析結果は表6のとおりであった。
3
(起
源株)接種群のSARS-CoV-2感染歴がない163例を対象に、接種後1ヵ
月のSARS-CoV-2オミクロン株BA.1血清中和抗体価及び抗体応答率を
評価した結果、表1及び表2のとおり本剤接種群のコミナティ筋注(起
源株)接種群に対する優越性及び非劣性がそれぞれ示された。
(1)16歳以上の参加者
36523例(コミナティ筋注(起源株)接種群:18198例、プラセボ接
種群:18325例)を対象に、1つ目の主要有効性評価項目である「SARSCoV-2感染歴がない参加者での2回目接種後7日以降のSARS-CoV-2に
よる感染症に対するコミナティ筋注(起源株)の有効性[ワクチン
有効性1(VE1)
]
」を評価した。40137例(コミナティ筋注(起源株)
接種群:19965例、プラセボ接種群:20172例)を対象に、2つ目の主
要有効性評価項目である「SARS-CoV-2感染歴の有無を問わない参加
者での2回目接種後7日以降のSARS-CoV-2による感染症に対するコミ
ナティ筋注(起源株)の有効性(VE2)」を評価した。解析結果は表
4のとおりであった4)。
表1 本剤接種群のコミナティ筋注(起源株)接種群に対するSARS-CoV2オミクロン株BA.1血清中和抗体価(50%中和抗体価)の幾何平均
比
本剤接種群
コミナティ筋注(起源株)接種群
測定例数
GMT[両側95%信頼
区間]a)
(接種後1ヵ月)
測定例数
GMT[両側95%信頼
区間]a)
(接種後1ヵ月)
178
711.0
[588.3, 859.2]
163
455.8
[365.9, 567.6]
GMR
[両側95%信頼
区間]b)
表4 SARS-CoV-2による感染症に対する有効性
1.56
[1.17, 2.08]
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)優越性基準:GMR(本剤/コミナティ筋注(起源株))の両側95%信頼区間下限>1
VE1a)
表2 本剤接種群のコミナティ筋注(起源株)接種群に対するSARS-CoV2オミクロン株BA.1血清中和抗体応答率の差
本剤接種群
VE2a)
コミナティ筋注(起源株)接種群
測定例数
na)(抗体応答率[%])
[両側95%信頼区間]
(接種後1ヵ月)
測定例数
169
121(71.6)
[64.2, 78.3]
149
差(%)
na)(抗体応答率[%]) [両側95%信頼区
[両側95%信頼区間]
間]b)
(接種後1ヵ月)
85(57.0)
[48.7, 65.1]
解析対象例数
SARS-CoV-2
による感染症
確定例数
コミナティ筋注
(起源株)接種群
18198
8
プラセボ接種群
18325
162
コミナティ筋注
(起源株)接種群
19965
9
プラセボ接種群
20172
169
ワクチン有効性
[95%信用区間](%)
95.0[90.3, 97.6]
94.6[89.9, 97.3]
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はそれぞれ57日と55日であった。また、VE1
及びVE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2でそれぞ
れ19~23日間の参加者は96.5%(35248例)と96.3%(38665例)、24~42日間の参加者は3.5%
(1275例)と3.7%(1472例)であった5)
14.6
[4.0, 24.9]
16歳以上の43448例(コミナティ筋注(起源株)接種群:21720例、プ
ラセボ接種群:21728例)を対象にコミナティ筋注(起源株)接種後の
安全性を評価した。一部の参加者(解析対象例数:1回目接種後8183
例、2回目接種後7507例)で治験薬接種後7日間、電子日誌により副反
応の発現状況を評価した。主な副反応の発現状況(事象全体及びGrade
3以上)は表5のとおりであった4)。注射部位疼痛は接種当日(中央値)
に発現し、持続期間は2日(中央値)であった。その他の全身性の事象
は接種翌日(中央値)に発現し、持続期間は1日(中央値)であった5)。
a)抗体価が本剤接種前(SARS-CoV-2ワクチンとして4回目接種前)のベースライン値(ベース
ライン値が定量下限(LLOQ)未満の場合はLLOQ値)から4倍以上上昇した治験参加者数
b)非劣性マージン:抗体応答率の差(本剤 - コミナティ筋注(起源株))の両側95%信頼区
間下限>-5%
305例を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、
電子日誌により副反応の発現状況を評価した。主な副反応の発現状
況(事象全体及びGrade 3以上)は表3のとおりであった。注射部位
疼痛は接種翌日(中央値)に発現し、持続期間は2日(中央値)であ
った。その他の全身性の事象は接種翌日(中央値)に発現し、持続
期間は1~2日(中央値)であった3)。
表5 主な副反応の発現状況
発現例数(発現割合[%])
表3 主な副反応の発現状況
コミナティ筋注(起源株)接種群
発現例数(発現割合[%])
本剤接種群
接種
回数a)
評価
例数b)
事象全体
コミナティ筋注(起源株)接種群
Grade 3
以上c)
評価
例数b)
事象全体
Grade 3
以上c)
注射部
位疼痛
1
301
175(58.1)
1(0.3)
298
179(60.1)
1(0.3)
疲労
1
301
148(49.2)
5(1.7)
298
135(45.3)
1(0.3)
頭痛
1
301
101(33.6)
1(0.3)
298
79(26.5)
1(0.3)
筋肉痛
1
301
67(22.3)
0(―)
298
59(19.8)
0(―)
悪寒
1
301
39(13.0)
0(―)
298
49(16.4)
0(―)
関節痛
1
301
34(11.3)
0(―)
298
27(9.1)
0(―)
d)
1
301
15(5.0)
4(1.3)
298
11(3.7)
0(―)
発熱
注射部
位疼痛
疲労
頭痛
筋肉痛
悪寒
a)SARS-CoV-2ワクチンとして4回目接種
b)電子日誌により評価した例数
c)重症度が「高度(日常活動を妨げる)」以上として報告された事象
d)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
関節痛
発熱c)
17.1.2 海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)第Ⅱ/Ⅲ相パート
(参考:コミナティ筋注(起源株)
)
SARS-CoV-2ワクチン未接種の12歳以上の健康な参加者を対象に、コ
ミナティ筋注(起源株)30µgを19~23日間隔で2回接種したときの有
効性及び安全性を検討することを目的として、プラセボ対照無作為
化多施設共同試験を実施した。さらに、本試験でコミナティ筋注(起
源株)30µgを2回接種済みの18~55歳の参加者にコミナティ筋注(起
源株)30µgを1回接種したときの免疫原性及び安全性も検討した。
接種
回数
評価
例数a)
1
2
プラセボ接種群
事象全体
Grade 3
以上b)
評価
例数a)
事象全体
Grade 3
以上b)
4093
3186(77.8)
28(0.7)
4090
488(11.9)
2(0.0)
3758
2730(72.6)
33(0.9)
3749
372(9.9)
0(-)
1
4093
1700(41.5)
35(0.9)
4090
1172(28.7)
14(0.3)
2
3758
2086(55.5) 143(3.8)
3749
756(20.2)
16(0.4)
1
4093
1413(34.5)
25(0.6)
4090
1100(26.9)
22(0.5)
2
3758
1732(46.1)
76(2.0)
3749
735(19.6)
19(0.5)
1
4093
738(18.0)
14(0.3)
4090
398(9.7)
5(0.1)
2
3758
1260(33.5)
63(1.7)
3749
260(6.9)
4(0.1)
1
4093
434(10.6)
9(0.2)
4090
203(5.0)
3(0.1)
2
3758
1114(29.6)
62(1.6)
3749
125(3.3)
0(-)
1
4093
406(9.9)
7(0.2)
4090
247(6.0)
1(0.0)
2
3758
772(20.5)
27(0.7)
3749
170(4.5)
5(0.1)
1
4093
111(2.7)
8(0.2)
4090
27(0.7)
7(0.2)
2
3758
512(13.6)
32(0.9)
3749
14(0.4)
3(0.1)
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
(2)12~15歳の参加者
12~15歳の参加者における有効性を追加で評価した。1983例(コミ
ナティ筋注(起源株)接種群:1005例、プラセボ接種群:978例)を
対象に「SARS-CoV-2感染歴がない参加者での2回目接種後7日以降の
SARS-CoV-2による感染症に対するコミナティ筋注(起源株)の有効
性[ワクチン有効性1(VE1)
]
」を、2229例(コミナティ筋注(起源
株)接種群:1119例、プラセボ接種群:1110例)を対象に「SARS-CoV2感染歴の有無を問わない参加者での2回目接種後7日以降のSARSCoV-2による感染症に対するコミナティ筋注(起源株)の有効性
(VE2)」
を評価した。解析結果は表6のとおりであった。
3