よむ、つかう、まなぶ。
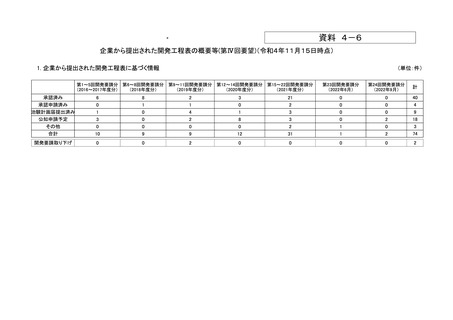
資料4-6 企業から提出された開発工程表の概要等(第IV回要望) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00025.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第53回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
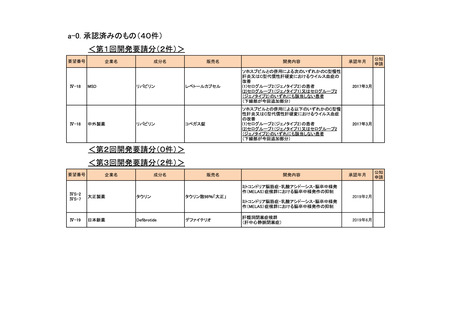
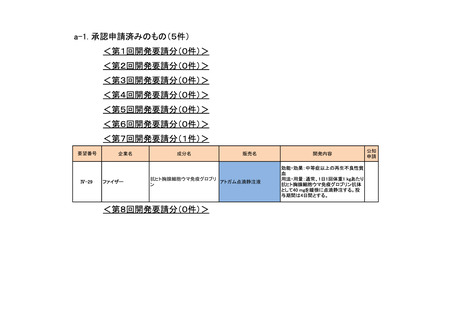
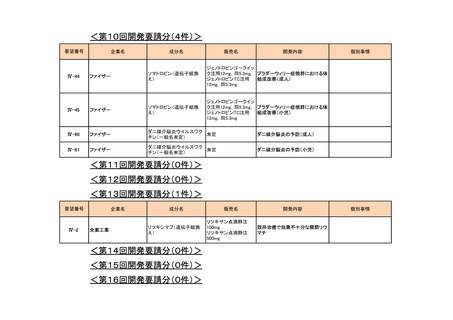
<第12回開発要請分(0件)>
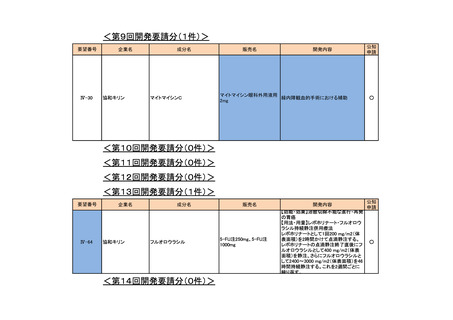
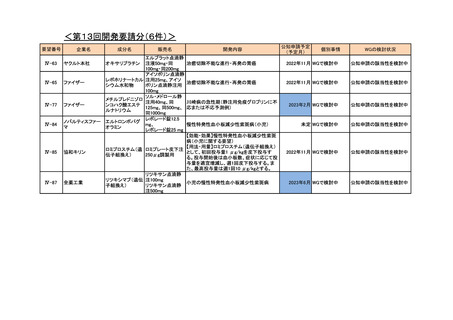
<第13回開発要請分(0件)>
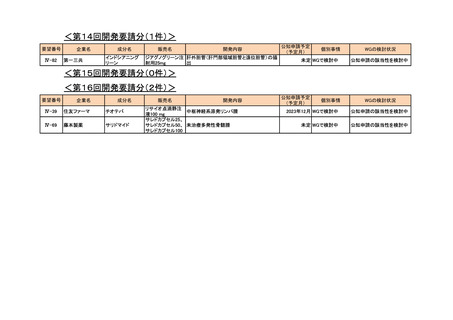
<第14回開発要請分(0件)>
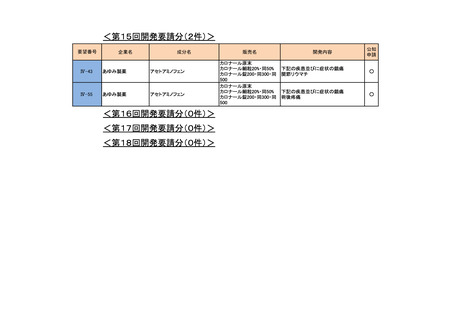
<第15回開発要請分(0件)>
<第16回開発要請分(0件)>
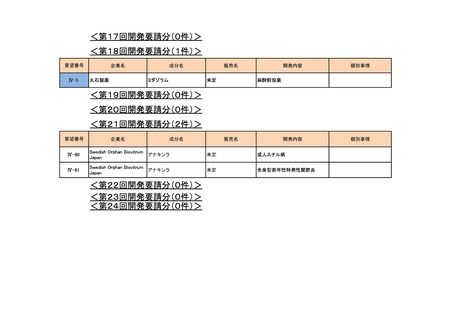
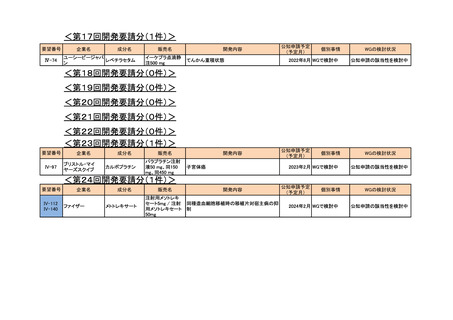
<第17回開発要請分(0件)>
<第18回開発要請分(0件)>
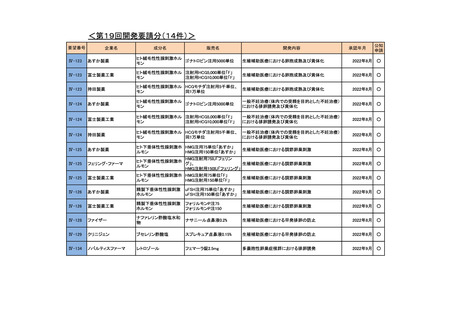
<第19回開発要請分(0件)>
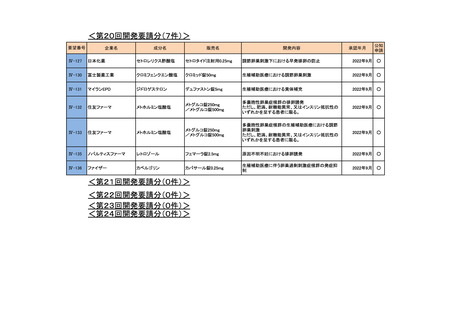
<第20回開発要請分(0件)>
<第21回開発要請分(0件)>
<第22回開発要請分(0件)>
<第23回開発要請分(0件)>
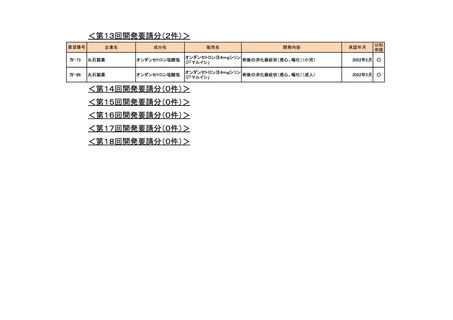
<第24回開発要請分(1件)>
要望番号
IV-94
IV-141
企業名
塩野義製薬
成分名
販売名
注射用エンドキサ
シクロホスファミド ン100 mg
水和物
注射用エンドキサ
ン500 mg
開発内容
血縁者間同種造血細胞移植 (HLA 半合致移
植) 時の移植片対宿主病の抑制
公知申請予定
(予定月)
個別事情
WGの検討状況
2023年3月 WGで検討中 公知申請の該当性を検討中
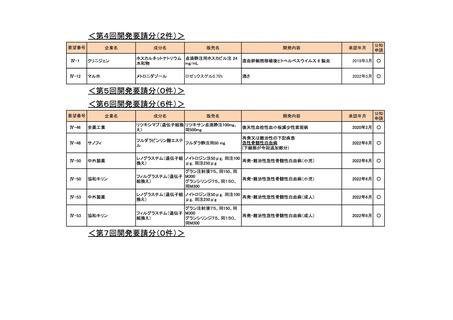
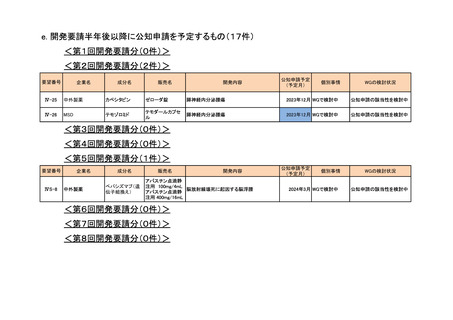
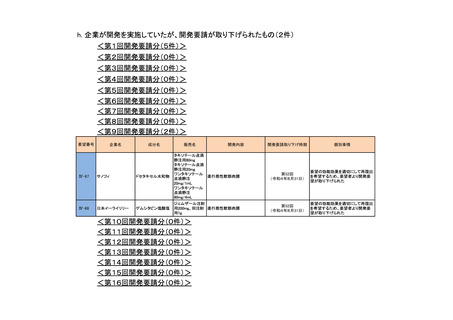
<第13回開発要請分(0件)>
<第14回開発要請分(0件)>
<第15回開発要請分(0件)>
<第16回開発要請分(0件)>
<第17回開発要請分(0件)>
<第18回開発要請分(0件)>
<第19回開発要請分(0件)>
<第20回開発要請分(0件)>
<第21回開発要請分(0件)>
<第22回開発要請分(0件)>
<第23回開発要請分(0件)>
<第24回開発要請分(1件)>
要望番号
IV-94
IV-141
企業名
塩野義製薬
成分名
販売名
注射用エンドキサ
シクロホスファミド ン100 mg
水和物
注射用エンドキサ
ン500 mg
開発内容
血縁者間同種造血細胞移植 (HLA 半合致移
植) 時の移植片対宿主病の抑制
公知申請予定
(予定月)
個別事情
WGの検討状況
2023年3月 WGで検討中 公知申請の該当性を検討中