よむ、つかう、まなぶ。
資料1-1薬機法改正関係 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30193.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和4年度第2回 1/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
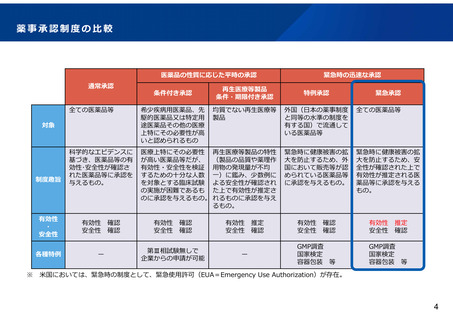
塩野義製薬の経口薬ゾコーバ錠(緊急承認)について
11/22時点
成分名
効能・効果
エンシトレルビル フマル酸(販売名:ゾコーバ錠125mg)
SARS-CoV-2による感染症
開発企業
種別 / 薬理作用
塩野義製薬
低分子化合物/プロテアーゼ阻害
軽症~中等症Ⅰの患者
対象患者
用法・用量
承認日 / 期限
※感染症学会のガイドライン 「COVID-19に対する薬物治療の考え方」
・重症化リスク因子のない患者:臨床試験成績等を踏まえ、高熱・強い咳症状・強い咽頭痛などの臨床症状がある者に処方を検討
・重症化リスク因子のある患者:重症化予防効果が確認されているレムデシビル、モルヌピラビル、ニルマトレルビル/リトナビルによる治療を検討
1日1回、5日間、経口投与
※通常、12歳以上の小児及び成人にはエンシトレルビルとして1日目は375mgを、2~5日目は125mg
※症状が発現してから遅くとも72時間以内に初回投与すること
令和4年11月22日 / 期限:1年
申請・審議経過
2月25日
承認申請(条件付承認を希望)
5月20日
薬機法改正。これを受けて緊急承認制度の適用希望。
6月22日
薬食審医薬品第2部会 審議
→「さらに慎重に議論を重ねる必要がある」との意見。
7月20日
薬食審 分科会・部会 合同審議(公開)
→現時点で提出されているデータ(第2b相試験)からは有効性は
推定されるとは判断できないことから、今後、現在実施中の第3相
臨床試験の結果等の提出を待って改めて審議することとされた。
9月28日
11月22日
企業から、第3相試験の結果、症状快復に関する主要評価項
目を達成した旨を発表。
薬食審 分科会・部会 合同審議(公開)
→有効性が推定され、緊急承認可との結論。(同日承認)
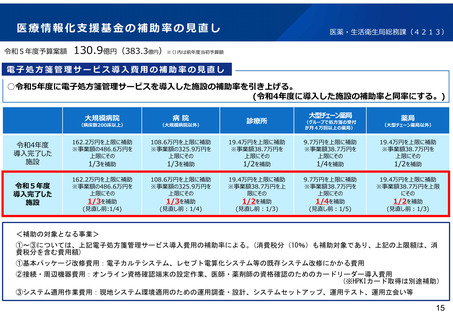
試験成績
ゾコーバ錠の第3相試験における主要評価項目である「5症状の快
復までの期間」は下表のとおりであり、申請用量である125mg群とプラ
セボとの間で統計的に有意差が認められた。
例数
5症状の快復ま
での期間
プラセボとの差
P値
本剤125mg
336例
167.9時間
-24.3時間
p=0.04
(本剤250mg)
329例
171.2時間
-21.0時間
p=0.02
プラセボ
321例
192.2時間
※5症状:鼻水・鼻づまり、喉の痛み、咳、熱っぽさ・発熱、けん怠感(疲労感)
主要な副次評価項目であるウイルスRNA量の変化量についても、プラ
セボに対して有意に大きかった。
7
11/22時点
成分名
効能・効果
エンシトレルビル フマル酸(販売名:ゾコーバ錠125mg)
SARS-CoV-2による感染症
開発企業
種別 / 薬理作用
塩野義製薬
低分子化合物/プロテアーゼ阻害
軽症~中等症Ⅰの患者
対象患者
用法・用量
承認日 / 期限
※感染症学会のガイドライン 「COVID-19に対する薬物治療の考え方」
・重症化リスク因子のない患者:臨床試験成績等を踏まえ、高熱・強い咳症状・強い咽頭痛などの臨床症状がある者に処方を検討
・重症化リスク因子のある患者:重症化予防効果が確認されているレムデシビル、モルヌピラビル、ニルマトレルビル/リトナビルによる治療を検討
1日1回、5日間、経口投与
※通常、12歳以上の小児及び成人にはエンシトレルビルとして1日目は375mgを、2~5日目は125mg
※症状が発現してから遅くとも72時間以内に初回投与すること
令和4年11月22日 / 期限:1年
申請・審議経過
2月25日
承認申請(条件付承認を希望)
5月20日
薬機法改正。これを受けて緊急承認制度の適用希望。
6月22日
薬食審医薬品第2部会 審議
→「さらに慎重に議論を重ねる必要がある」との意見。
7月20日
薬食審 分科会・部会 合同審議(公開)
→現時点で提出されているデータ(第2b相試験)からは有効性は
推定されるとは判断できないことから、今後、現在実施中の第3相
臨床試験の結果等の提出を待って改めて審議することとされた。
9月28日
11月22日
企業から、第3相試験の結果、症状快復に関する主要評価項
目を達成した旨を発表。
薬食審 分科会・部会 合同審議(公開)
→有効性が推定され、緊急承認可との結論。(同日承認)
試験成績
ゾコーバ錠の第3相試験における主要評価項目である「5症状の快
復までの期間」は下表のとおりであり、申請用量である125mg群とプラ
セボとの間で統計的に有意差が認められた。
例数
5症状の快復ま
での期間
プラセボとの差
P値
本剤125mg
336例
167.9時間
-24.3時間
p=0.04
(本剤250mg)
329例
171.2時間
-21.0時間
p=0.02
プラセボ
321例
192.2時間
※5症状:鼻水・鼻づまり、喉の痛み、咳、熱っぽさ・発熱、けん怠感(疲労感)
主要な副次評価項目であるウイルスRNA量の変化量についても、プラ
セボに対して有意に大きかった。
7