よむ、つかう、まなぶ。
総-6○先進医療会議からの報告について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
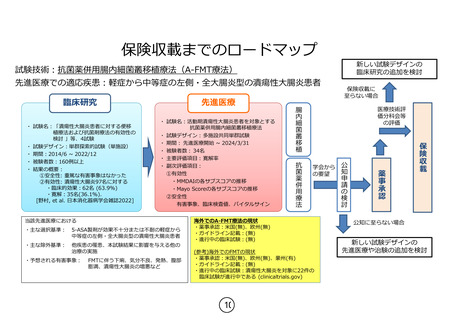
保険収載までのロードマップ
新しい試験デザインの
臨床研究の追加を検討
試験技術:抗菌薬併用腸内細菌叢移植療法(A-FMT療法)
先進医療での適応疾患:軽症から中等症の左側・全大腸炎型の潰瘍性大腸炎患者
・主な選択基準:
5-ASA製剤が効果不十分または不耐の軽症から
中等症の左側・全大腸炎型の潰瘍性大腸炎患者
・主な除外基準:
他疾患の罹患、本試験結果に影響を与える他の
治療の実施
・予想される有害事象:
FMTに伴う下痢、気分不良、発熱、腹部
膨満、潰瘍性大腸炎の増悪など
海外でのA-FMT療法の現状
・薬事承認:米国(無)、欧州(無)
・ガイドライン記載:(無)
・進行中の臨床試験:(無)
(参考)海外でのFMTの現状
・薬事承認:米国(無)、欧州(無)、豪州(有)
・ガイドライン記載:(無)
・進行中の臨床試験:潰瘍性大腸炎を対象に22件の
臨床試験が進行中である (clinicaltrials.gov)
10
保険収載
当該先進医療における
学会から
の要望
薬事承認
・ 試験名:活動期潰瘍性大腸炎患者を対象とする
抗菌薬併用腸内細菌叢移植療法
・ 試験デザイン:多施設共同単群試験
・ 期間: 先進医療開始 ~ 2024/3/31
・ 被験者数: 34名
・ 主要評価項目:寛解率
・ 副次評価項目:
①有効性
・MMDAIの各サブスコアの推移
・Mayo Scoreの各サブスコアの推移
②安全性
有害事象、臨床検査値、バイタルサイン
医療技術評
価分科会等
の評価
公知申請の検討
・ 試験名:「潰瘍性大腸炎患者に対する便移
植療法および抗菌剤療法の有効性の
検討 」等、4試験
・ 試験デザイン:単群探索的試験(単施設)
・ 期間:2014/6 ~ 2022/12
・ 被験者数:160例以上
・ 結果の概要:
①安全性: 重篤な有害事象はなかった
②有効性: 潰瘍性大腸炎97名に対する
・臨床的効果:62名 (63.9%)
・寛解:35名(36.1%).
[野村, et al. 日本消化器病学会雑誌2022]
抗菌薬併用療法
先進医療
腸内細菌叢移植
臨床研究
保険収載に
至らない場合
公知に至らない場合
新しい試験デザインの
先進医療や治験の追加を検討
新しい試験デザインの
臨床研究の追加を検討
試験技術:抗菌薬併用腸内細菌叢移植療法(A-FMT療法)
先進医療での適応疾患:軽症から中等症の左側・全大腸炎型の潰瘍性大腸炎患者
・主な選択基準:
5-ASA製剤が効果不十分または不耐の軽症から
中等症の左側・全大腸炎型の潰瘍性大腸炎患者
・主な除外基準:
他疾患の罹患、本試験結果に影響を与える他の
治療の実施
・予想される有害事象:
FMTに伴う下痢、気分不良、発熱、腹部
膨満、潰瘍性大腸炎の増悪など
海外でのA-FMT療法の現状
・薬事承認:米国(無)、欧州(無)
・ガイドライン記載:(無)
・進行中の臨床試験:(無)
(参考)海外でのFMTの現状
・薬事承認:米国(無)、欧州(無)、豪州(有)
・ガイドライン記載:(無)
・進行中の臨床試験:潰瘍性大腸炎を対象に22件の
臨床試験が進行中である (clinicaltrials.gov)
10
保険収載
当該先進医療における
学会から
の要望
薬事承認
・ 試験名:活動期潰瘍性大腸炎患者を対象とする
抗菌薬併用腸内細菌叢移植療法
・ 試験デザイン:多施設共同単群試験
・ 期間: 先進医療開始 ~ 2024/3/31
・ 被験者数: 34名
・ 主要評価項目:寛解率
・ 副次評価項目:
①有効性
・MMDAIの各サブスコアの推移
・Mayo Scoreの各サブスコアの推移
②安全性
有害事象、臨床検査値、バイタルサイン
医療技術評
価分科会等
の評価
公知申請の検討
・ 試験名:「潰瘍性大腸炎患者に対する便移
植療法および抗菌剤療法の有効性の
検討 」等、4試験
・ 試験デザイン:単群探索的試験(単施設)
・ 期間:2014/6 ~ 2022/12
・ 被験者数:160例以上
・ 結果の概要:
①安全性: 重篤な有害事象はなかった
②有効性: 潰瘍性大腸炎97名に対する
・臨床的効果:62名 (63.9%)
・寛解:35名(36.1%).
[野村, et al. 日本消化器病学会雑誌2022]
抗菌薬併用療法
先進医療
腸内細菌叢移植
臨床研究
保険収載に
至らない場合
公知に至らない場合
新しい試験デザインの
先進医療や治験の追加を検討