よむ、つかう、まなぶ。
総-6○先進医療会議からの報告について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【倫理的観点からの評価】 評価者:
一家
4.同意に係る手続き、同意文書
適
・
不適
5.補償内容
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
最初に申請された説明文書に対しては多岐に亘る修正事項を指摘したが、それ
らの指摘に基づいて適切に修正対応された。将来的な普及の段階でも検体提供者
(ドナー)の確保に課題があるように考えるが、検体提供者の募集場面での倫理的
配慮には引き続き留意して頂きたい。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
【試験実施計画書等の評価】 評価者:
上村(夕)
6.期待される適応症、効能及び効果
適
・
不適
7.予測される安全性情報
適
・
不適
8.被験者の適格基準及び選定方法
適
・
不適
9.治療計画の内容
適
・
不適
10.有効性及び安全性の評価方法
適
・
不適
11.モニタリング体制及び実施方法
適
・
不適
12.被験者等に対して重大な事態が生じた場合の
対処方法
適
・
不適
13.試験に係る記録の取扱い及び管理・保存方法
適
・
不適
14.患者負担の内容
適
・
不適
15.起こりうる利害の衝突及び研究者等の関連組織
との関わり
適
・
不適
16.個人情報保護の方法
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
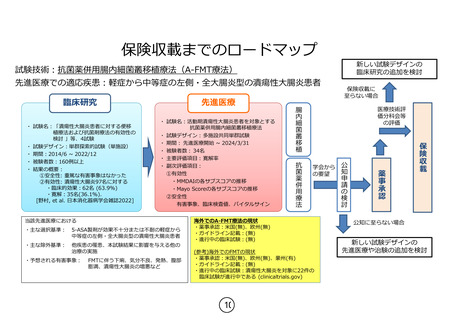
本研究は 5-ASA 製剤の効果が不十分または不耐な活動期の UC 患者で、ステロイ
ド局所製剤の適応のない左側・全大腸炎型の患者 37 例を対象として、抗菌薬併用
腸内細菌叢移植療法(A-FMT 療法)の有効性および安全性の評価を行います。FMT
治療開始後 8 週時における寛解率を主要評価項目とし、ブデソニド注腸フォーム
剤国内第 3 相試験のプラセボ群のデータよりヒストリカルコントロールとして設
定した閾値 21%と比較する多施設共同単群試験です。
単群試験であるため有効性の適切な評価には限界はあると考えるものの、適切
なヒストリカルコントロールデータが存在すること、本試験の対象となる患者が
本邦において約 4600 名程度と少なく十分な症例を集めることが難しい等の実施可
能性も踏まえ、適と判断いたしました。
また、8 週時のデータが収集できかった症例における有効性評価の扱いについて
不明瞭な点がございましたが、適切にご回答いただきプロトコルへの反映がされ
ましたので、いずれも適としております。
4
一家
4.同意に係る手続き、同意文書
適
・
不適
5.補償内容
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
最初に申請された説明文書に対しては多岐に亘る修正事項を指摘したが、それ
らの指摘に基づいて適切に修正対応された。将来的な普及の段階でも検体提供者
(ドナー)の確保に課題があるように考えるが、検体提供者の募集場面での倫理的
配慮には引き続き留意して頂きたい。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
【試験実施計画書等の評価】 評価者:
上村(夕)
6.期待される適応症、効能及び効果
適
・
不適
7.予測される安全性情報
適
・
不適
8.被験者の適格基準及び選定方法
適
・
不適
9.治療計画の内容
適
・
不適
10.有効性及び安全性の評価方法
適
・
不適
11.モニタリング体制及び実施方法
適
・
不適
12.被験者等に対して重大な事態が生じた場合の
対処方法
適
・
不適
13.試験に係る記録の取扱い及び管理・保存方法
適
・
不適
14.患者負担の内容
適
・
不適
15.起こりうる利害の衝突及び研究者等の関連組織
との関わり
適
・
不適
16.個人情報保護の方法
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
本研究は 5-ASA 製剤の効果が不十分または不耐な活動期の UC 患者で、ステロイ
ド局所製剤の適応のない左側・全大腸炎型の患者 37 例を対象として、抗菌薬併用
腸内細菌叢移植療法(A-FMT 療法)の有効性および安全性の評価を行います。FMT
治療開始後 8 週時における寛解率を主要評価項目とし、ブデソニド注腸フォーム
剤国内第 3 相試験のプラセボ群のデータよりヒストリカルコントロールとして設
定した閾値 21%と比較する多施設共同単群試験です。
単群試験であるため有効性の適切な評価には限界はあると考えるものの、適切
なヒストリカルコントロールデータが存在すること、本試験の対象となる患者が
本邦において約 4600 名程度と少なく十分な症例を集めることが難しい等の実施可
能性も踏まえ、適と判断いたしました。
また、8 週時のデータが収集できかった症例における有効性評価の扱いについて
不明瞭な点がございましたが、適切にご回答いただきプロトコルへの反映がされ
ましたので、いずれも適としております。
4