よむ、つかう、まなぶ。
総-4-1○患者申出療養評価会議からの報告について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00175.html |
| 出典情報 | 中央社会保険医療協議会 総会(第538回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
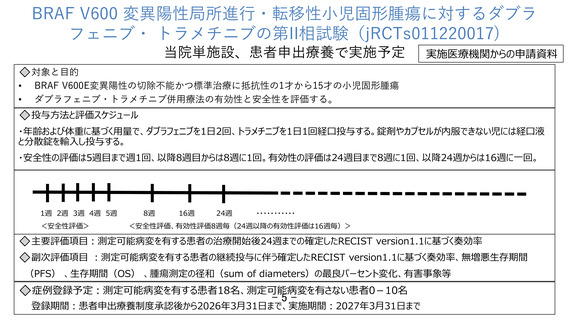
ット試験である BRF117019 試験(NCT02034110)と NCI-MATCH 試験(NCT2465060) (Arm H)、
および小児対象の BRAF V600 変異陽性の固形腫瘍に対する第 I/II 相試験である X2101
試験(NCT02124772)の結果に基づいて行われた。
小児対象の X2101 試験に含まれる患者の中で、同併用療法を行った 36 例の LGG を有
する患者における奏効率が報告され、25%(95%CI、12.1~42.2)であった。
成人対象の上記 2 試験における BRAF V600E 陽性固形腫瘍に対する同併用療法の奏効
率は、胆道癌(n = 48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、
低悪性度漿液性卵巣癌(n = 5) 80%、小腸癌(n = 4) 50%など、種々のがん種で良好な
結果が報告された。また、小児の BRAFV600 変異を有する Wilms 腫瘍や思春期・若年成
人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったと
する症例報告がある。
以上より、小児患者においても、神経膠腫を含む BRAF V600E 変異陽性の固形腫瘍に
対する同併用療法の効果が期待される。
(患者申出療養に係る費用)
患者申出療養にかかる費用として、医師・看護師・薬剤師の人件費
臨床研究支援等支援部門
554,033 円
1症例につき
57,923 円
合計 611,956 円が必要
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無
償提供する。
臨床研究中核病院
北海道大学病院
協力医療機関
なし
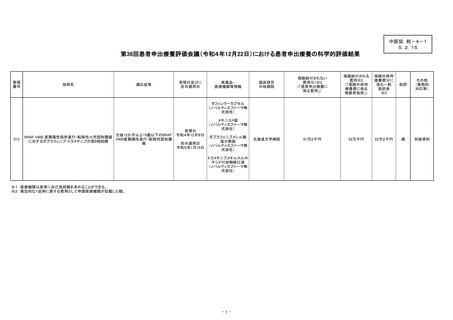
2.患者申出療養評価会議における審議概要及び審議結果
(1)開催日時:令和4年 12 月 22 日(木)
第 36 回患者申出療養評価会議
(2)審議概要及び審議結果
北海道大学病院を介して、前例のない患者申出療養として患者より申出のあっ
た新規医療技術に関して、患者申出療養評価会議において有効性・安全性、技術
的妥当性、保険給付との併用の適否等にかかる観点から論点整理を進め、本会議
からの指摘に対して適切な回答がなされたことをうけ、当該新規技術の申請内容
が患者申出療養として妥当であると判断した。
(議論の概要等)
・ 当該医療技術が治験や先進医療等の他の制度で実施できない理由について、
医療機関に確認したところ、BRAFV600 変異陽性の低悪性度神経膠腫、若しく
は再発又は難治性高悪性度神経膠腫を有する小児患者を対象としたダブラフ
-3-
および小児対象の BRAF V600 変異陽性の固形腫瘍に対する第 I/II 相試験である X2101
試験(NCT02124772)の結果に基づいて行われた。
小児対象の X2101 試験に含まれる患者の中で、同併用療法を行った 36 例の LGG を有
する患者における奏効率が報告され、25%(95%CI、12.1~42.2)であった。
成人対象の上記 2 試験における BRAF V600E 陽性固形腫瘍に対する同併用療法の奏効
率は、胆道癌(n = 48)46%、高悪性度神経膠腫(HGG)(n = 48)33%、LGG (n = 14) 50%、
低悪性度漿液性卵巣癌(n = 5) 80%、小腸癌(n = 4) 50%など、種々のがん種で良好な
結果が報告された。また、小児の BRAFV600 変異を有する Wilms 腫瘍や思春期・若年成
人の膵腺房細胞癌に対してダブラフェニブ・トラメチニブ併用療法が有効であったと
する症例報告がある。
以上より、小児患者においても、神経膠腫を含む BRAF V600E 変異陽性の固形腫瘍に
対する同併用療法の効果が期待される。
(患者申出療養に係る費用)
患者申出療養にかかる費用として、医師・看護師・薬剤師の人件費
臨床研究支援等支援部門
554,033 円
1症例につき
57,923 円
合計 611,956 円が必要
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無
償提供する。
臨床研究中核病院
北海道大学病院
協力医療機関
なし
2.患者申出療養評価会議における審議概要及び審議結果
(1)開催日時:令和4年 12 月 22 日(木)
第 36 回患者申出療養評価会議
(2)審議概要及び審議結果
北海道大学病院を介して、前例のない患者申出療養として患者より申出のあっ
た新規医療技術に関して、患者申出療養評価会議において有効性・安全性、技術
的妥当性、保険給付との併用の適否等にかかる観点から論点整理を進め、本会議
からの指摘に対して適切な回答がなされたことをうけ、当該新規技術の申請内容
が患者申出療養として妥当であると判断した。
(議論の概要等)
・ 当該医療技術が治験や先進医療等の他の制度で実施できない理由について、
医療機関に確認したところ、BRAFV600 変異陽性の低悪性度神経膠腫、若しく
は再発又は難治性高悪性度神経膠腫を有する小児患者を対象としたダブラフ
-3-