よむ、つかう、まなぶ。
総-4-1○患者申出療養評価会議からの報告について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00175.html |
| 出典情報 | 中央社会保険医療協議会 総会(第538回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
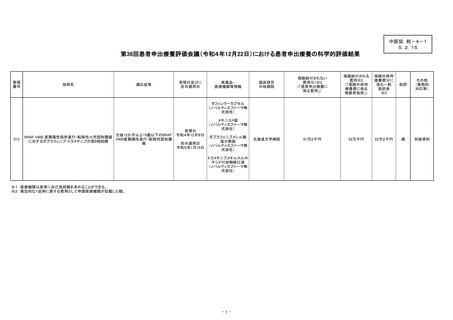
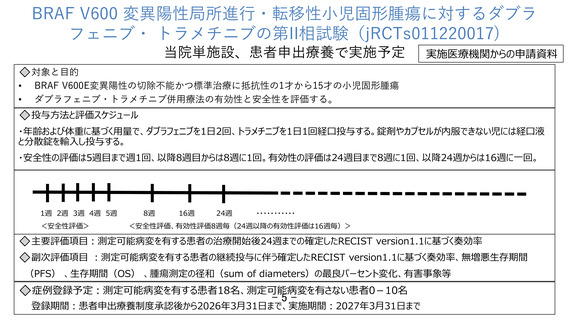
ェニブ・トラメチニブ併用療法の効果を評価する第 II 相試験が、日本を含む
国際共同企業治験として実施されているが、登録期間が終了し、現在は新規患
者が参加することができず、また、小児患者の脳腫瘍以外の固形腫瘍に対する
治験・拡大治験や先進医療は実施されていないこと。
また、製販企業から小児固形腫瘍に対する治験または先進医療制度での当
該医薬品の薬剤提供はできないが、患者申出療養制度で実施される場合は、
人道的な見地より、当該医薬品の無償提供を行うことは可能との回答があっ
たため、他に標準治療がない小児患者と家族の思いに応える形で、患者申出
療養制度を用いる、との回答を得た。
・ 事前評価担当構成員からは研究実施計画書等の修正等の必要性につき指摘が
あり、いずれも事前に適切な回答が得られた一方で、単施設研究である研究実
施体制については会議で議論される必要があるとされ、事前の総合評価として
は「条件付き適」と判断された。
・
患者申出療養評価会議においては、当該技術について、症例数を十分に集
積すること及び患者の利便性を確保する観点から、半年後に実施状況及び多
施設研究への移行状況を会議に報告することをもって、「適」と判断された。
-4-
国際共同企業治験として実施されているが、登録期間が終了し、現在は新規患
者が参加することができず、また、小児患者の脳腫瘍以外の固形腫瘍に対する
治験・拡大治験や先進医療は実施されていないこと。
また、製販企業から小児固形腫瘍に対する治験または先進医療制度での当
該医薬品の薬剤提供はできないが、患者申出療養制度で実施される場合は、
人道的な見地より、当該医薬品の無償提供を行うことは可能との回答があっ
たため、他に標準治療がない小児患者と家族の思いに応える形で、患者申出
療養制度を用いる、との回答を得た。
・ 事前評価担当構成員からは研究実施計画書等の修正等の必要性につき指摘が
あり、いずれも事前に適切な回答が得られた一方で、単施設研究である研究実
施体制については会議で議論される必要があるとされ、事前の総合評価として
は「条件付き適」と判断された。
・
患者申出療養評価会議においては、当該技術について、症例数を十分に集
積すること及び患者の利便性を確保する観点から、半年後に実施状況及び多
施設研究への移行状況を会議に報告することをもって、「適」と判断された。
-4-