よむ、つかう、まなぶ。
医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会 報告書 参考資料 (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33548.html |
| 出典情報 | 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会 報告書の公表について(6/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
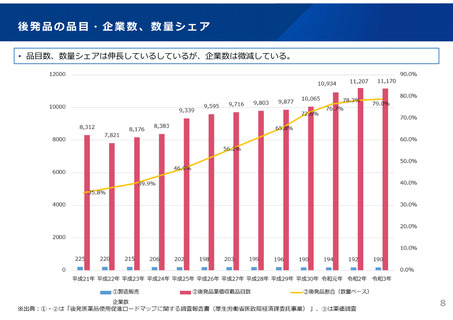
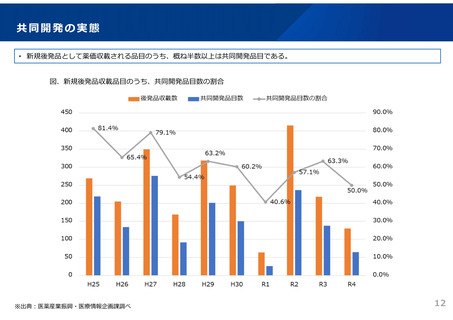
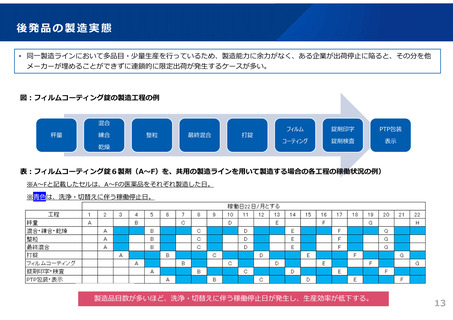
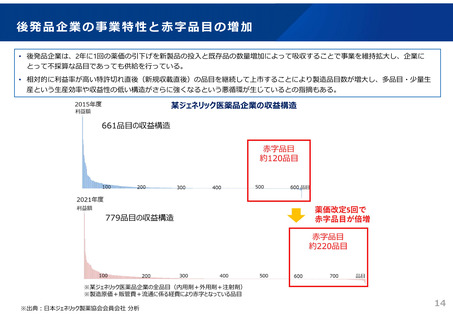
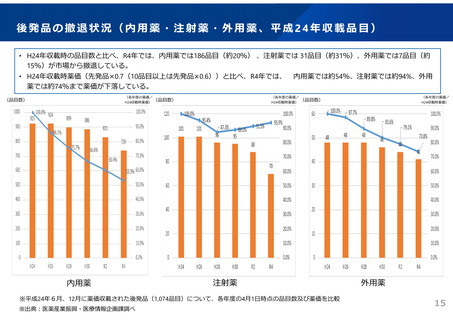
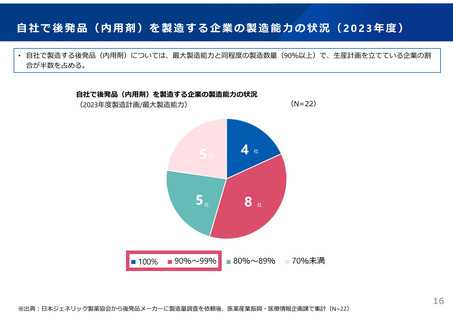
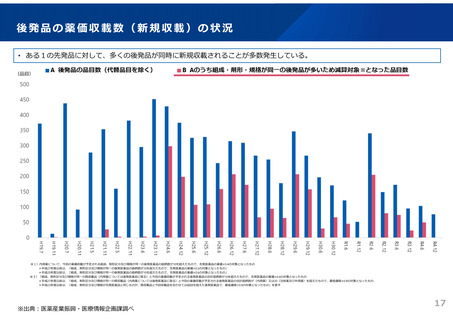
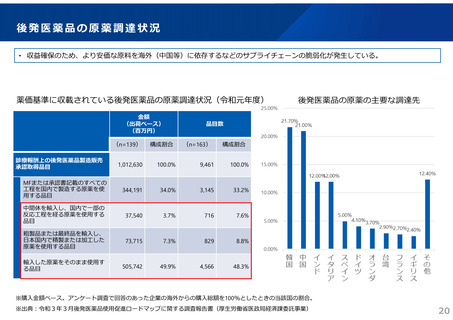
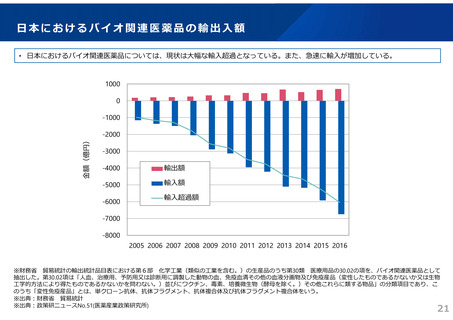
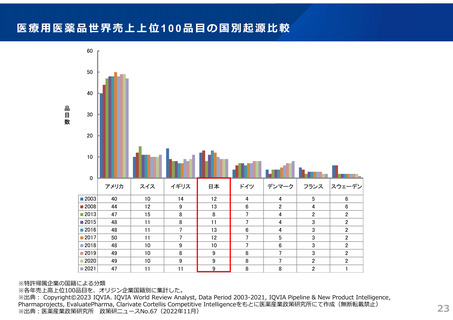
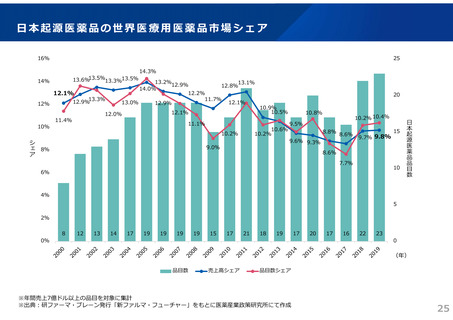
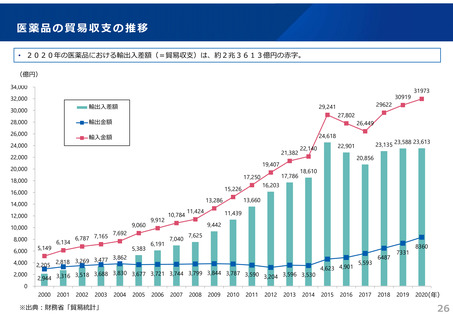
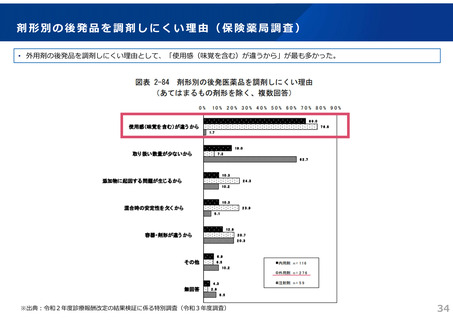
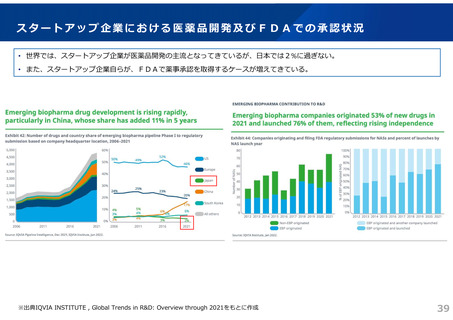
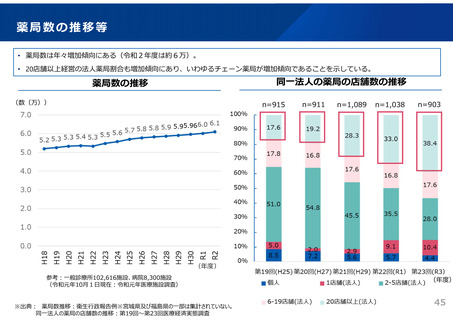
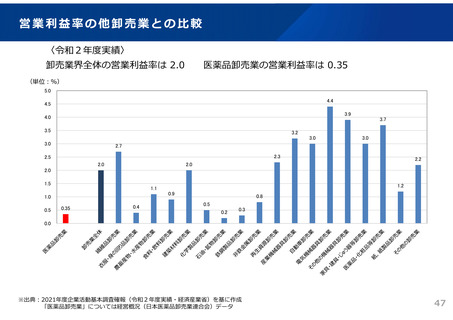
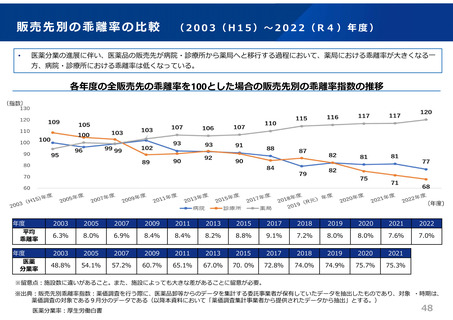
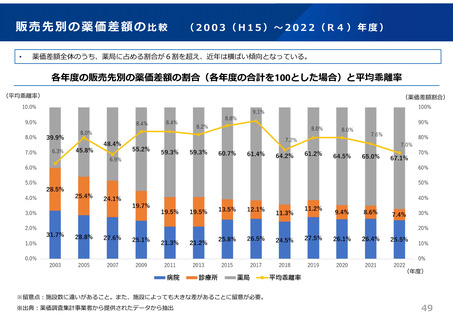
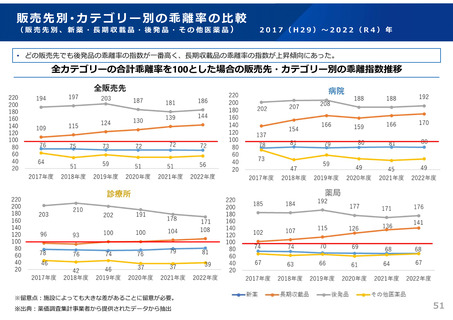
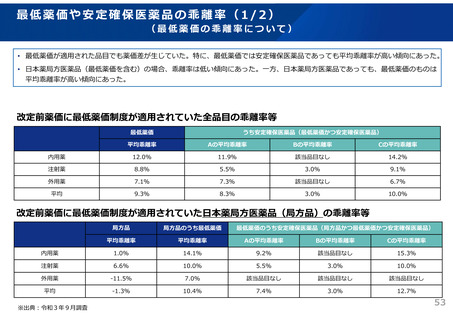
ドラッグ・ラグ/ドラッグ・ロスの実態
•
•
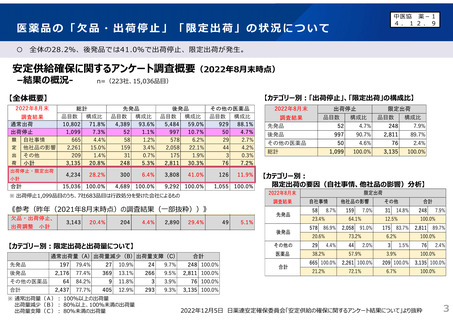
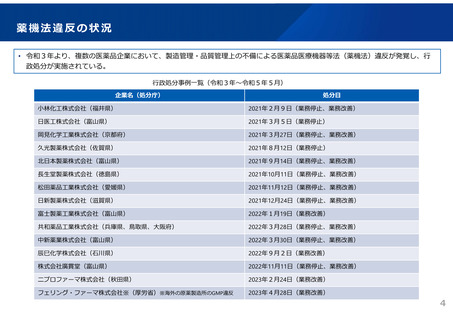
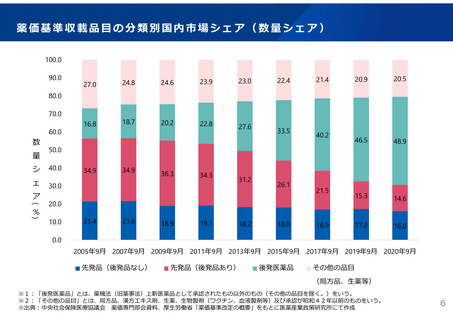
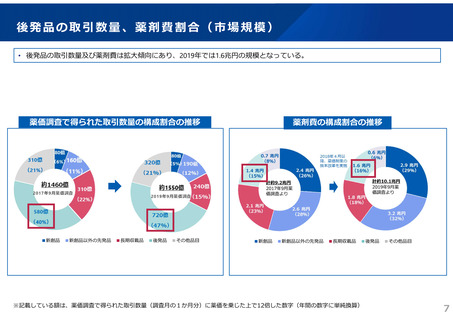
2023年3月時点において、欧米では承認されているが国内開発未着手の医薬品は86品目(未承認薬のうち60.1%)あり、そもそも
承認申請がなされない(=企業が開発しない)というドラッグラグ・ロスが発生していると指摘されている。
国内開発状況が未着手の86品目について傾向を分析したところ、ベンチャー発の医薬品や、オーファン、小児の割合が比較的大き
いことが分かった。
日欧米のドラッグラグ・ロスの状況
米国
承認済
未承認合計
136
7
日本国内未着手の品目内訳
未承認の内数 (品目数)
開発中
未着手
3
4
欧州
86
57
26
31
日本
0
143
57
86
内訳
ベンチャー発
オーファン
小児
56
47
37
%
(48品目)
%
(40品目)
%
(32品目)
※ロス86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
(品目)
※出典:PMDA、FDA、EMA の各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※1:2016-2020年に欧米で承認されたNMEのうち、2022年末時点で日本では承認を受けていない品目を未承認として集計
※2:2023年3月時点で開発情報のない品目を国内開発の未着手として集計
※3:欧米の承認取得年が設立から30年以内で承認取得前年の売上が5億米ドル未満の開発企業をベンチャーとして集計
※4:欧米にてオーファンドラッグ指定を承認時までに受けた品目をオーファンとして集計
※5:2022年末時点で欧米で小児適応を取得した品目を小児として集計
42
•
•
2023年3月時点において、欧米では承認されているが国内開発未着手の医薬品は86品目(未承認薬のうち60.1%)あり、そもそも
承認申請がなされない(=企業が開発しない)というドラッグラグ・ロスが発生していると指摘されている。
国内開発状況が未着手の86品目について傾向を分析したところ、ベンチャー発の医薬品や、オーファン、小児の割合が比較的大き
いことが分かった。
日欧米のドラッグラグ・ロスの状況
米国
承認済
未承認合計
136
7
日本国内未着手の品目内訳
未承認の内数 (品目数)
開発中
未着手
3
4
欧州
86
57
26
31
日本
0
143
57
86
内訳
ベンチャー発
オーファン
小児
56
47
37
%
(48品目)
%
(40品目)
%
(32品目)
※ロス86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
(品目)
※出典:PMDA、FDA、EMA の各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※1:2016-2020年に欧米で承認されたNMEのうち、2022年末時点で日本では承認を受けていない品目を未承認として集計
※2:2023年3月時点で開発情報のない品目を国内開発の未着手として集計
※3:欧米の承認取得年が設立から30年以内で承認取得前年の売上が5億米ドル未満の開発企業をベンチャーとして集計
※4:欧米にてオーファンドラッグ指定を承認時までに受けた品目をオーファンとして集計
※5:2022年末時点で欧米で小児適応を取得した品目を小児として集計
42