よむ、つかう、まなぶ。
【参考資料3】国際共同治験に関する基本的な考え方(薬食審査発第0928010号) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35181.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第3回 9/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
拠が諸外国におけるエビデンスに大きく依存しているような場合には、基本的には、諸外国
と同一の併用薬、併用療法等を用いて国内での臨床試験を実施する方が理論的であり、かつ
試験の成功率を高めるものと考えられる。
(1) 抗がん剤の併用療法のように、治療域が狭く毒性の強い薬剤同士を併用するような
場、国内外で厳密に同一の用法・用量を設定することが望ましい。
(2) ある疾患に対して用いられる標準的治療法として通常併用される薬剤又は治療法に
ついては、各地域の用法・用量を同一に規定することが困難であることも想定される。この
ような場合、必要最小限の差異については許容可能であるが、これらの差異が治験薬の有効
性及び安全性に及ぼす影響を最小限にとどめるため、併用時の用法・用量等を前観察期も含
めて治験期間中は変更せず、患者ごとに一定にするなどの配慮が必要である。
11. 国際共同治験を実施することが望ましい領域はあるか?
どのような領域であっても国際共同治験を実施することは可能であるが、希少疾病等の国
内で大規模な検証試験を実施することが困難と考えられる疾患であれば、より積極的に国際
共同治験の実施を検討すべきである。これまでは国内で少数例の使用経験的な試験が実施さ
れている場合もあったが、このような開発戦略よりも、国際共同治験の中に可能な限り多く
の日本人の症例を組み入れ、より適切な臨床試験デザインに基づくエビデンスを構築するこ
とが望ましい。また、希少疾病でなくても、生存率等の真の臨床的エンドポイントを用いた
臨床試験で症例数が数千例規模に上る場合等、
世界的にも症例の集積に時間を要すると予想
される時には、日本も積極的に参加してエビデンスの構築に貢献することも考えられる。こ
のような方策をとることで、最終的には各地域での承認申請時期を同様とすることが可能に
なると考えられる。
12. 国際共同治験を実施することの適否を判断する上で、参考となるフローチャートはあ
るか?
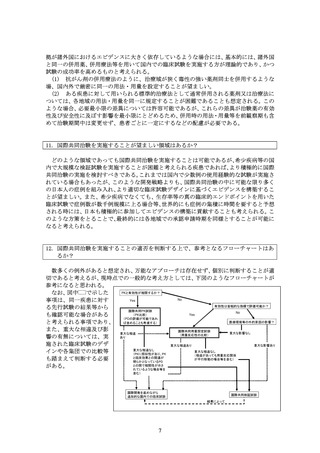
数多くの例外があると想定され、万能なアプローチは存在せず、個別に判断することが適
切であると考えるが、現時点での一般的な考え方としては、下図のようなフローチャートが
参考になると思われる。
PKと有効性が相関するか?
なお、図中 で示した
No
Yes
事項は、同一疾患に対す
有効性は客観的な指標で評価可能か?
る先行試験の結果等から
国際共同PK試験
No
Yes
(PK比較)
も確認可能な場合がある
(PDの評価が可能であれ
医療環境等の外的要因の影響?
と考えられる事項であり、
ば含めることも考慮する)
また、重大な相違及び影
国際共同用量設定試験
重大な影響なし
重大な相違
(用量反応性の比較)
あり
響の有無については、実
施された臨床試験のデザ
重大な影響あり
重大な相違あり
重大な相違なし
重大な相違なし
インや各集団での比較等
(PKに類似性があり、PK
(相違があっても用量反応関係
と臨床効果との関連が
が平行移動の場合等を含む)
も踏まえて判断する必要
明らかとなっているPD
との間で相関性が示さ
がある。
れているような場合等を
含む)
国際開発を進めながら
追加的な国内での臨床試験
国際共同検証試験
結果によって
7
と同一の併用薬、併用療法等を用いて国内での臨床試験を実施する方が理論的であり、かつ
試験の成功率を高めるものと考えられる。
(1) 抗がん剤の併用療法のように、治療域が狭く毒性の強い薬剤同士を併用するような
場、国内外で厳密に同一の用法・用量を設定することが望ましい。
(2) ある疾患に対して用いられる標準的治療法として通常併用される薬剤又は治療法に
ついては、各地域の用法・用量を同一に規定することが困難であることも想定される。この
ような場合、必要最小限の差異については許容可能であるが、これらの差異が治験薬の有効
性及び安全性に及ぼす影響を最小限にとどめるため、併用時の用法・用量等を前観察期も含
めて治験期間中は変更せず、患者ごとに一定にするなどの配慮が必要である。
11. 国際共同治験を実施することが望ましい領域はあるか?
どのような領域であっても国際共同治験を実施することは可能であるが、希少疾病等の国
内で大規模な検証試験を実施することが困難と考えられる疾患であれば、より積極的に国際
共同治験の実施を検討すべきである。これまでは国内で少数例の使用経験的な試験が実施さ
れている場合もあったが、このような開発戦略よりも、国際共同治験の中に可能な限り多く
の日本人の症例を組み入れ、より適切な臨床試験デザインに基づくエビデンスを構築するこ
とが望ましい。また、希少疾病でなくても、生存率等の真の臨床的エンドポイントを用いた
臨床試験で症例数が数千例規模に上る場合等、
世界的にも症例の集積に時間を要すると予想
される時には、日本も積極的に参加してエビデンスの構築に貢献することも考えられる。こ
のような方策をとることで、最終的には各地域での承認申請時期を同様とすることが可能に
なると考えられる。
12. 国際共同治験を実施することの適否を判断する上で、参考となるフローチャートはあ
るか?
数多くの例外があると想定され、万能なアプローチは存在せず、個別に判断することが適
切であると考えるが、現時点での一般的な考え方としては、下図のようなフローチャートが
参考になると思われる。
PKと有効性が相関するか?
なお、図中 で示した
No
Yes
事項は、同一疾患に対す
有効性は客観的な指標で評価可能か?
る先行試験の結果等から
国際共同PK試験
No
Yes
(PK比較)
も確認可能な場合がある
(PDの評価が可能であれ
医療環境等の外的要因の影響?
と考えられる事項であり、
ば含めることも考慮する)
また、重大な相違及び影
国際共同用量設定試験
重大な影響なし
重大な相違
(用量反応性の比較)
あり
響の有無については、実
施された臨床試験のデザ
重大な影響あり
重大な相違あり
重大な相違なし
重大な相違なし
インや各集団での比較等
(PKに類似性があり、PK
(相違があっても用量反応関係
と臨床効果との関連が
が平行移動の場合等を含む)
も踏まえて判断する必要
明らかとなっているPD
との間で相関性が示さ
がある。
れているような場合等を
含む)
国際開発を進めながら
追加的な国内での臨床試験
国際共同検証試験
結果によって
7