よむ、つかう、まなぶ。
08 資料4_ワクチンの研究開発支援について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37873.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会研究開発及び生産・流通部会(第34回 2/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
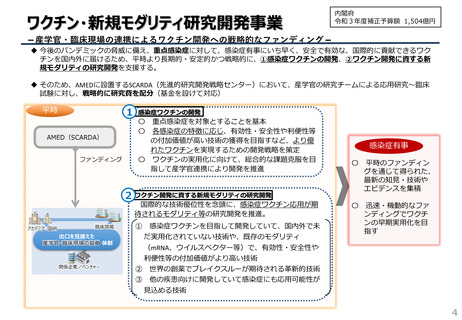
コロナワクチン開発の進捗状況<主なもの>
開発企業(※1)
(2023年12月20日時点)
取り組み状況(※2)
交付基準額(※3)
①第一三共
東大医科研
第Ⅰ/Ⅱ相試験を開始(2021年3月)
第Ⅱ相試験を開始(2021年11月)
ブースター用試験を開始(2022年1月)
ブースター用試験の第Ⅲ相試験を開始(2022年5月)
第Ⅲ相試験を開始(2022年9月)
※mRNAワクチン
ブースター用試験の第Ⅲ相試験(変異株対応ワクチン)を開始(2023年5月)
小児(5~11歳)ブースター用第Ⅱ/Ⅲ相試験(変異株対応ワクチン)を開始(2023年5月)
成人向けブースター用ワクチン(起源株対応)薬事承認(2023年8月2日)
起源株ワクチン薬事承認 12歳以上向けブースター用ワクチン(オミクロン株XBB.1.5系統対応)薬事承認(2023年11月28日)
XBB.1.5系統対応ワクチン薬事承認 令和5年秋開始接種向け供給開始(2023年12月4日)
生産体制等緊急整備
事業で603.0億円を補
助
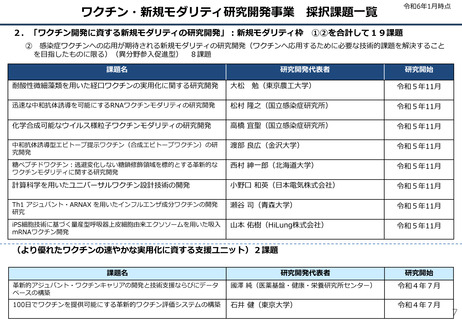
②Meiji Seikaファルマ
生産体制等緊急整備
事業で62.3億円を補
助
※mRNAワクチン(レプリコン)
起源株ワクチン薬事承認
ブースター用の第Ⅲ相試験を開始(2022年12月)
ブースター用の第III相試験(変異株対応ワクチン)を開始(2023年9月)
成人用初回免疫用・ブースター用ワクチン(起源株対応)薬事承認(2023年11月28日)
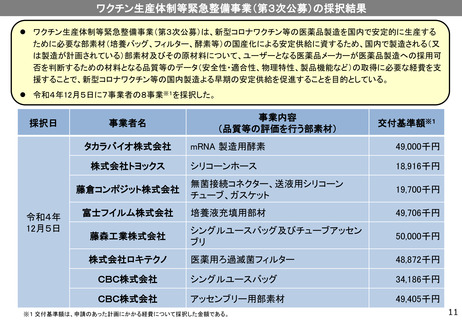
③塩野義製薬
感染研/UMNファーマ
第Ⅰ/Ⅱ相試験を開始(2020年12月)
アジュバントを変更した製剤による第Ⅰ/Ⅱ相試験を開始(2021年8月)
第II/III相試験を開始(2021年10月)
第Ⅲ相試験を開始(①発症予防効果検証 2021年12月、②抗体価の比較 2022年1月)
ブースター用試験を開始(2021年12月)
※組換えタンパクワクチン
青少年(12‐19歳)用第Ⅱ/Ⅲ相試験を開始(2022年5月)
小児(5-11歳)用第Ⅰ/Ⅱ/Ⅲ相試験(第1期) を開始(2022年7月)
60歳以上の4回目接種に係る第Ⅱ/Ⅲ試験を開始(2022年7月)
成人用初回免疫用・ブースター用ワクチンについて、薬事承認申請(2022年11月24日)
起源株ワクチン承認申請中 小児(5-11歳)用第Ⅰ/Ⅱ/Ⅲ相試験(第2期)、小児(5-11歳)用ブースター用第Ⅲ相試験を開始(2023年1月)
ブースター用第Ⅲ相試験(変異株対応ワクチン)を開始(2023年12月)
生産体制等緊急整備
事業で489.8億円を補
助
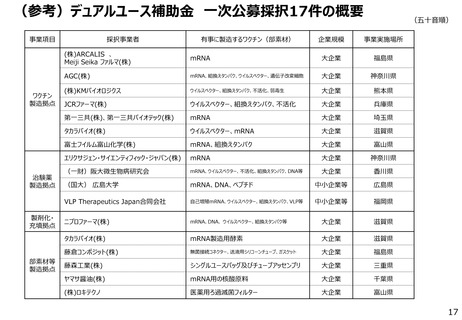
④KMバイオロジクス
東大医科研/感染研/基盤研
/Meiji Seikaファルマ
生産体制等緊急整備
事業で435.5億円を補
助
※不活化ワクチン
第Ⅰ/Ⅱ相試験を開始(2021年3月)
第II/III相試験を開始(2021年10月)
第Ⅲ相試験を開始(2022年4月)
小児用第Ⅱ/Ⅲ相試験を開始(2022年4月)
小児用第Ⅲ相試験を開始(2023年1月)
小児第Ⅲ相(発症予防効果検証)試験を開始(オミクロン株XBB.1.5ワクチン、2023年12月)
⑤VLP セラピューティクスジャパ 第Ⅰ相試験を開始(2021年10月)
ブースター用試験を開始(2022年2月)
ン
ブースター用試験の第Ⅱ相試験を開始(2022年9月)
※mRNAワクチン(レプリコン)
ブースター用試験の第Ⅰ/Ⅱ相試験(変異株対応ワクチン)を開始(2023年4月)
ブースター用試験の第Ⅲ相試験(オミクロン株XBB.1.5系統対応ワクチン)を開始(2023年12月)
⑥アンジェス
阪大/タカラバイオ
2020年6月、9月に第Ⅰ/Ⅱ相試験を開始し、その後、2020年12月に第Ⅱ/Ⅲ相試験を開始したが、期待する効果を
得られず。
高用量製剤での臨床試験(第Ⅰ/Ⅱ相試験相当)を開始(2021年8月)
主要評価項目が期待する水準に至らず開発中止(2022年9月)
※DNAワクチン
開発中止
※1 生産体制等緊急整備事業で採択された企業を掲載
※2 取り組み状況については、開発者から聞き取り
生産体制等緊急整備
事業で182.9億円を補
助
生産体制等緊急整備
事業で93.8億円を補
助
※3 生産体制等緊急整備事業に基づく交付基準額を記載 12
開発企業(※1)
(2023年12月20日時点)
取り組み状況(※2)
交付基準額(※3)
①第一三共
東大医科研
第Ⅰ/Ⅱ相試験を開始(2021年3月)
第Ⅱ相試験を開始(2021年11月)
ブースター用試験を開始(2022年1月)
ブースター用試験の第Ⅲ相試験を開始(2022年5月)
第Ⅲ相試験を開始(2022年9月)
※mRNAワクチン
ブースター用試験の第Ⅲ相試験(変異株対応ワクチン)を開始(2023年5月)
小児(5~11歳)ブースター用第Ⅱ/Ⅲ相試験(変異株対応ワクチン)を開始(2023年5月)
成人向けブースター用ワクチン(起源株対応)薬事承認(2023年8月2日)
起源株ワクチン薬事承認 12歳以上向けブースター用ワクチン(オミクロン株XBB.1.5系統対応)薬事承認(2023年11月28日)
XBB.1.5系統対応ワクチン薬事承認 令和5年秋開始接種向け供給開始(2023年12月4日)
生産体制等緊急整備
事業で603.0億円を補
助
②Meiji Seikaファルマ
生産体制等緊急整備
事業で62.3億円を補
助
※mRNAワクチン(レプリコン)
起源株ワクチン薬事承認
ブースター用の第Ⅲ相試験を開始(2022年12月)
ブースター用の第III相試験(変異株対応ワクチン)を開始(2023年9月)
成人用初回免疫用・ブースター用ワクチン(起源株対応)薬事承認(2023年11月28日)
③塩野義製薬
感染研/UMNファーマ
第Ⅰ/Ⅱ相試験を開始(2020年12月)
アジュバントを変更した製剤による第Ⅰ/Ⅱ相試験を開始(2021年8月)
第II/III相試験を開始(2021年10月)
第Ⅲ相試験を開始(①発症予防効果検証 2021年12月、②抗体価の比較 2022年1月)
ブースター用試験を開始(2021年12月)
※組換えタンパクワクチン
青少年(12‐19歳)用第Ⅱ/Ⅲ相試験を開始(2022年5月)
小児(5-11歳)用第Ⅰ/Ⅱ/Ⅲ相試験(第1期) を開始(2022年7月)
60歳以上の4回目接種に係る第Ⅱ/Ⅲ試験を開始(2022年7月)
成人用初回免疫用・ブースター用ワクチンについて、薬事承認申請(2022年11月24日)
起源株ワクチン承認申請中 小児(5-11歳)用第Ⅰ/Ⅱ/Ⅲ相試験(第2期)、小児(5-11歳)用ブースター用第Ⅲ相試験を開始(2023年1月)
ブースター用第Ⅲ相試験(変異株対応ワクチン)を開始(2023年12月)
生産体制等緊急整備
事業で489.8億円を補
助
④KMバイオロジクス
東大医科研/感染研/基盤研
/Meiji Seikaファルマ
生産体制等緊急整備
事業で435.5億円を補
助
※不活化ワクチン
第Ⅰ/Ⅱ相試験を開始(2021年3月)
第II/III相試験を開始(2021年10月)
第Ⅲ相試験を開始(2022年4月)
小児用第Ⅱ/Ⅲ相試験を開始(2022年4月)
小児用第Ⅲ相試験を開始(2023年1月)
小児第Ⅲ相(発症予防効果検証)試験を開始(オミクロン株XBB.1.5ワクチン、2023年12月)
⑤VLP セラピューティクスジャパ 第Ⅰ相試験を開始(2021年10月)
ブースター用試験を開始(2022年2月)
ン
ブースター用試験の第Ⅱ相試験を開始(2022年9月)
※mRNAワクチン(レプリコン)
ブースター用試験の第Ⅰ/Ⅱ相試験(変異株対応ワクチン)を開始(2023年4月)
ブースター用試験の第Ⅲ相試験(オミクロン株XBB.1.5系統対応ワクチン)を開始(2023年12月)
⑥アンジェス
阪大/タカラバイオ
2020年6月、9月に第Ⅰ/Ⅱ相試験を開始し、その後、2020年12月に第Ⅱ/Ⅲ相試験を開始したが、期待する効果を
得られず。
高用量製剤での臨床試験(第Ⅰ/Ⅱ相試験相当)を開始(2021年8月)
主要評価項目が期待する水準に至らず開発中止(2022年9月)
※DNAワクチン
開発中止
※1 生産体制等緊急整備事業で採択された企業を掲載
※2 取り組み状況については、開発者から聞き取り
生産体制等緊急整備
事業で182.9億円を補
助
生産体制等緊急整備
事業で93.8億円を補
助
※3 生産体制等緊急整備事業に基づく交付基準額を記載 12