資料3-2 製造販売業者からの国内副作用等報告の状況[3.9MB] (418 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
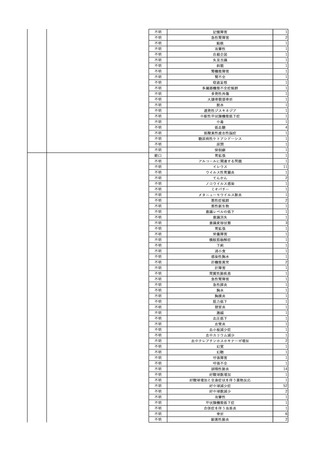
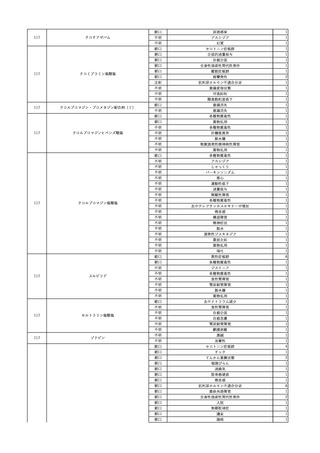
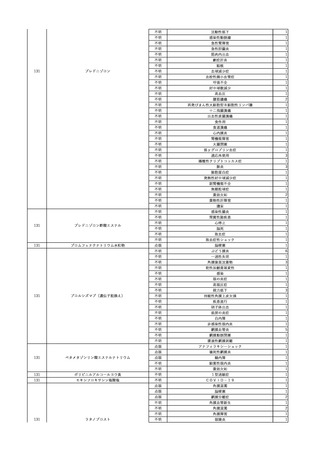
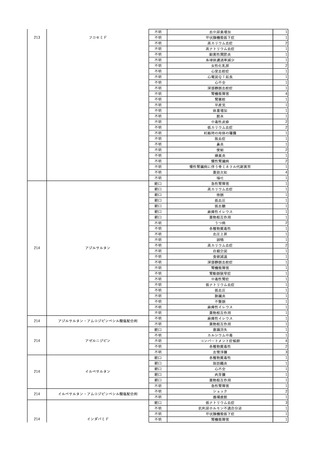
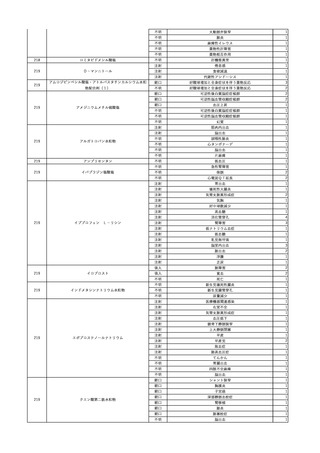
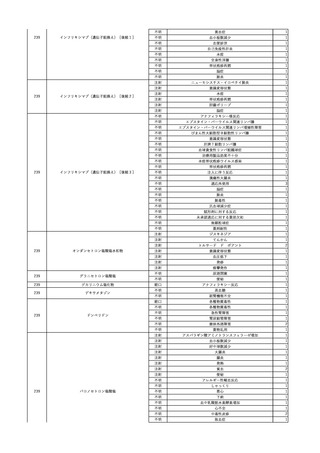
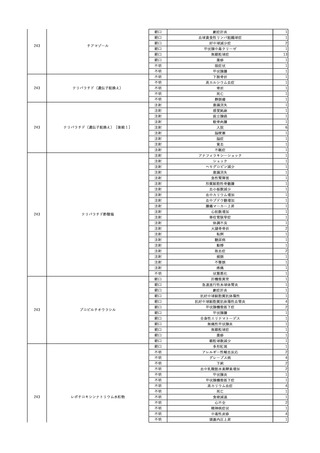
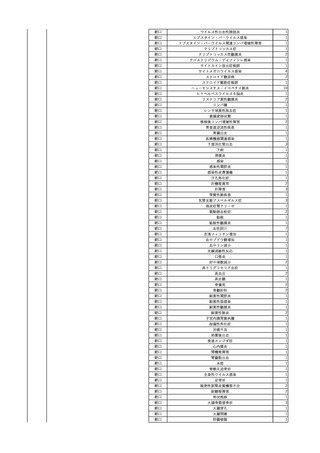
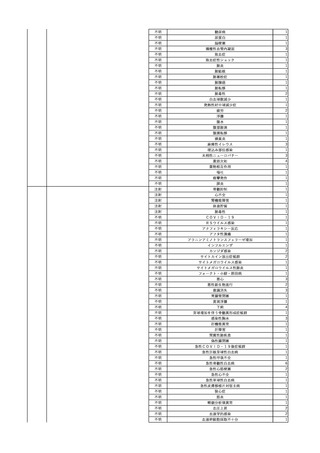
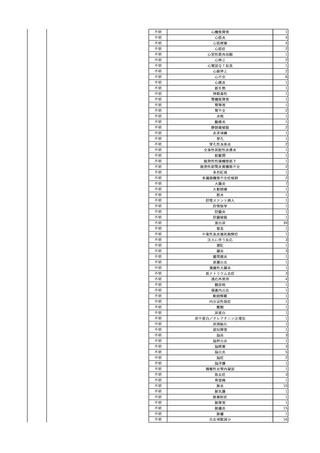
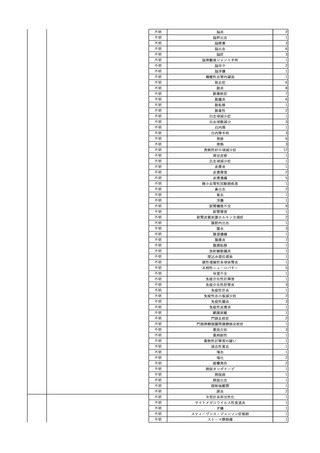
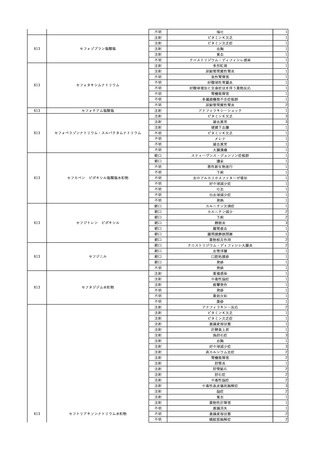
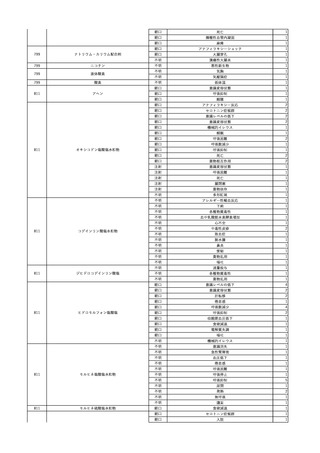
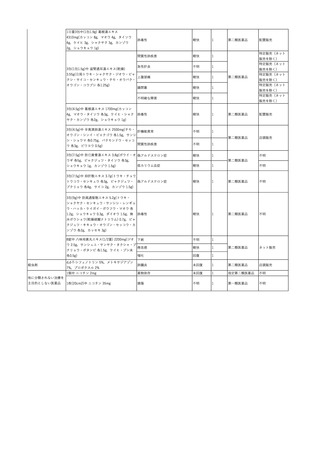
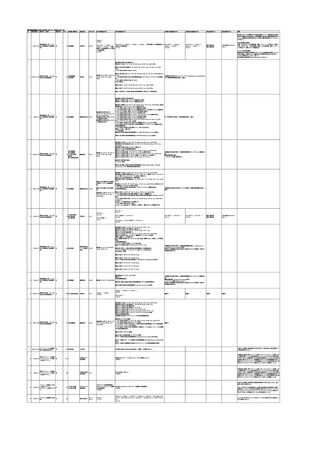
No.
報告受領日 販売名(一般名)
患者性別
年代
原疾患(簡略名)
感染症名
投与年月
投与前検査(年月)
投与後検査(年月)
企業投与前検査(年月)
企業投与後検査(年月)
受血者個別NAT
献血者個別NAT
献血者のHBV-DNA陽転化に係る遡及調査によって、当該献血者の前回
献血時の輸血用血液を供給した医療機関に献血者の陽転情報を提供した
ところ、当該輸血用血液を使用された患者が輸血後陽性となっていること
が判明した。
HBsAg(-)
(23/05)
1
照射濃厚血小板-LR(人
2023/12/7 血小板濃厚液(放射線照 男
射))
70 血液腫瘍
B型肝炎
23/08
備考
HBV-DNA(+)、HBsAg(+)、HBsAb(-)、HBcAb(-)(遡及調査による情報提供によ HBV-DNA(-)、HBsAg(-)、
HBV-DNA(-)、HBsAg(-)、
り実施した検査結果)
HBsAb(-)、HBcAb(-)
HBsAb(-)、HBcAb(-)(遡及
(23/12)
(23/08)
調査による情報提供により実施
した検査結果)
(23/08)
HBV-DNA(+)、HBsAg(+)、
HBsAb(-)、HBcAb(-)
(23/12)
陰性(輸血前)
陽性(輸血後)
1名の個別NATはHBVDNA(-)
【献血者陽転化情報】
当該 2023年8月 HBV関連検査 陰性、スクリーニング個別NAT 陰性
次回 2023年11月 HBs抗原検査 陽性、HBc抗体検査 陽性、スクリーニ
ング個別NAT 陽性(HBV)(陽転献血)
【ウイルス相同性確認】
陽転献血時の検体と患者検体中のウイルスの塩基配列を検査したところ、
両者は検査した範囲(PreS/S領域を含むP領域の前半部1556bp及び
CP/PreC領域624bp)で全て一致した。
献血者株及び患者株のHBVはGenotype A2であった。
輸血開始3時間9分後 輸血終了。
輸血終了2分後 BT 37.1℃、BP 92/59 mmHg、HR 90 /min、SpO2 98%。
輸血2日後 突然の高熱あり。BT 38.9℃、BP 110/67 mmHg、HR 105 /min、SpO2
99%。
バイタル測定6時間10分後 BT 40.0℃。
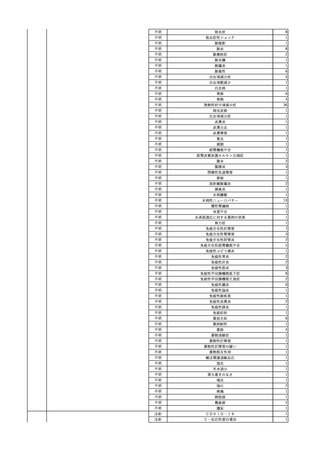
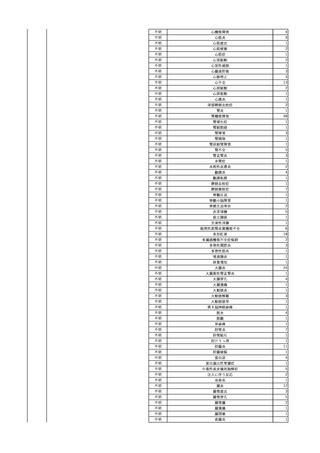
2 2023/12/18
照射赤血球液-LR(人赤
女
血球液(放射線照射))
40
生殖器腫瘍
血液疾患
敗血症
23/12
輸血3日後 体温上昇。BT 41.2℃、BP 106/68 mmHg、HR 134 /min、SpO2 88%(O2 2
輸血前日 BT 36.8℃、BP 93/72 L/min)。
当該輸血用血液のセグメントチューブにてStaphylococcus epidermidis に
mmHg、HR 92 /min、SpO2
バイタル測定4時間23分後 血液培養検査実施。タゾバクタム/ピペラシリン水和物開
対する細菌培養試験を実施し、陰性。
98%。
始。
バイタル測定12時間23分後 BT 36.9℃。
以降、発熱なし。
-
輸血4日後 BT 37.0℃、BP 82/58 mmHg、HR 87 /min、SpO2 100%。
輸血5日後 BT 36.3℃、BP 94/52 mmHg、HR 80 /min、SpO2 98%。
輸血7日後 院内にて実施の患者血液培養検査より表皮ブドウ球菌を検出。
輸血開始1時間28分後 輸血終了。
輸血終了6時間40分後 セフェピム塩酸塩投与開始。
輸血終了7時間40分後 セフェピム塩酸塩投与終了。
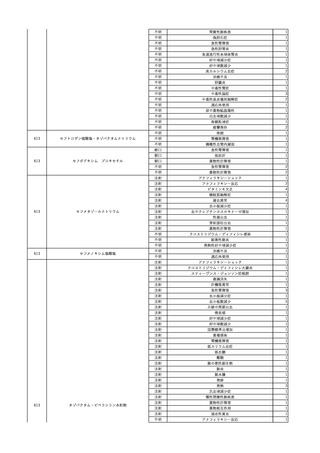
3
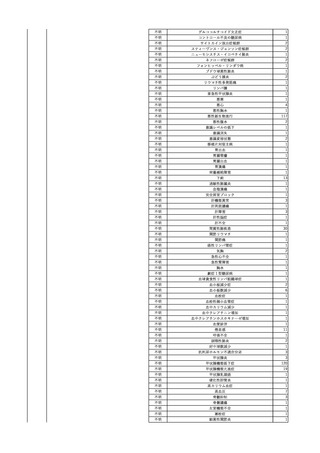
照射濃厚血小板-LR(人
2024/2/1 血小板濃厚液(放射線照 女
射))
60 血液腫瘍
細菌性敗血症 24/01
輸血翌日 発熱あり。BT 38.1℃、BP 138/80 mmHg、HR 93 /min、SpO2 98%。血液培
養検査実施。アセトアミノフェン 600 mg静注内投与。
バイタル測定1時間15分後 セフェピム塩酸塩投与開始。
バイタル測定2時間15分後 セフェピム塩酸塩投与終了。抗生剤をセフェピム塩酸塩か
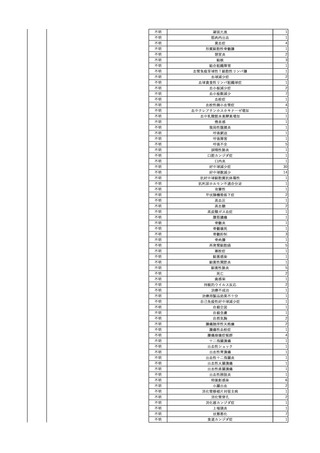
らメロペネム水和物へ変更。メロペネム水和物投与開始。
輸血開始3時間2分前 BT
バイタル測定3時間15分後 メロペネム水和物投与終了。
36.5℃、BP 126/79 mmHg、HR
バイタル測定6時間26分後 BT 37.9℃。アセトアミノフェン 600 mg静脈内投与。
86 /min、SpO2 99%。
バイタル測定8時間15分後 メロペネム水和物投与開始。
同一採血番号の血漿にて無菌試験を実施し、適合。
輸血開始2時間52分前 セフェピ
バイタル測定9時間15分後 メロペネム水和物投与終了。
ム塩酸塩投与開始。
バイタル測定10時間45分後 BT 39.3℃、BP 146/92 mmHg、HR 109 /min、SpO2
輸血開始1時間52分前 セフェピ
98%。アセトアミノフェン 600 mg内服。
ム塩酸塩投与終了。
バイタル測定13時間49分後 20秒ほどの痙攣発作あり。すみやかに改善。
バイタル測定14時間15分後 再度、強直性痙攣あり。ジアゼパム 2.5 mg静脈内投与。
強直性痙攣改善。
バイタル測定14時間30分後 頭部CTにて、明らかな出血なし。
意識レベル低下、嘔吐あり。
人工呼吸管理。
輸血翌日実施の患者血液培養検査より、4本中1本でBacillus cereus を検出。
-
-
-
-
-
-
陰性(輸血前)
陽性(輸血後)
7名の個別NATはHCVRNA(-)
当該輸血用血液の残余にて細菌培養試験を実施し、Streptococcus
dysgalactiae ssp. equisimilis を同定。
患者及び当該輸血用血液の残余より検出された2つの菌株にて遺伝子
型試験を実施予定。
-
-
当該輸血用血液の残余にて細菌培養試験及びエンドトキシン試験を実
施。
細菌培養試験:Serratia marcescens を同定。
エンドトキシン試験:2000 pg/mL以上。
患者及び当該輸血用血液の残余より検出された2つの菌株にて遺伝子
型試験を実施予定。
-
-
調査中
調査中
調査中
-
-
-
-
文献からの情報。使用製剤は不明であるが、文献内容から現行製剤によ
る感染症報告ではない。
-
当該製品は製造工程でエタノール分画、ポリエチレングリコール処理、イオ
ン交換体処理、ウイルス除去膜処理によりウイルスの不活化や除去処理
が行われており、医薬発第1047号 血漿分画製剤のウイルスに対する安全
性確保に関するガイドライン、医薬審第329号 ヒト又は動物細胞株を用いて
製造されるバイオテクノロジー応用医薬品のウイルス安全性評価に従い評
価されたウイルスクリアランス指数は9以上であることを確認している。
-
当該製品は製造工程でエタノール分画、ポリエチレングリコール処理、イオ
ン交換体処理、ウイルス除去膜処理によりウイルスの不活化や除去処理
が行われており、医薬発第1047号 血漿分画製剤のウイルスに対する安全
性確保に関するガイドライン、医薬審第329号 ヒト又は動物細胞株を用いて
製造されるバイオテクノロジー応用医薬品のウイルス安全性評価に従い評
価されたウイルスクリアランス指数は9以上であることを確認している。
輸血2日後 患者血液培養検査実施。4本中4本でBacillus cereus を検出。
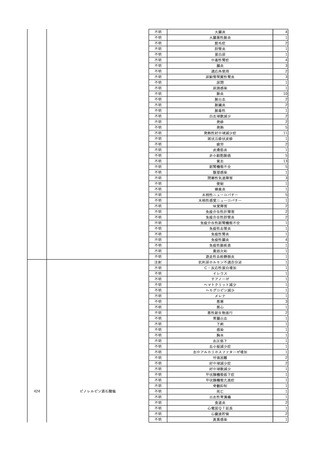
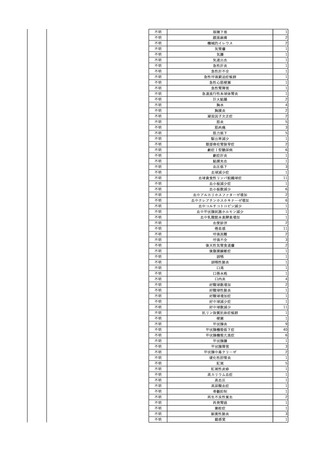
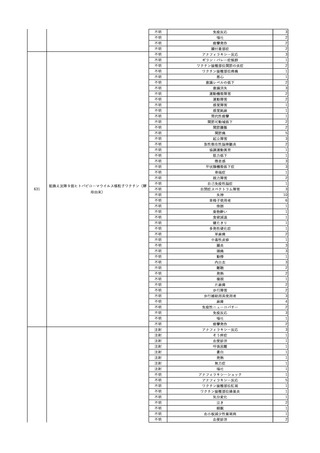
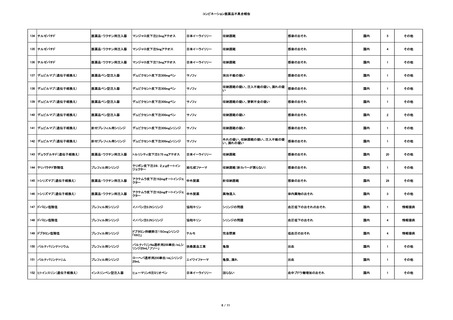
4
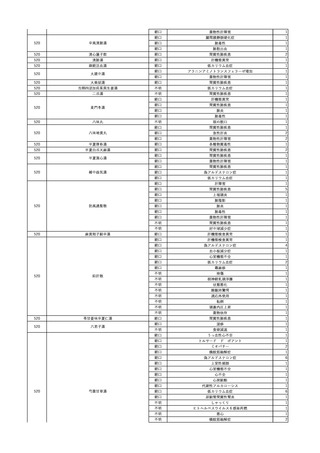
照射赤血球液-LR(人赤
2024/2/19
男
血球液(放射線照射))
消化器腫瘍
消化器腫瘍
70 その他の疾患
糖尿病
腎・泌尿器系疾患
細菌感染
24/01
輸血前 BT 37.3℃、BP 126/75
mmHg、HR 88 /min、SpO2
95%。
輸血開始30分後 BT 37.5℃、BP 133 /86mmHg、HR 86 /min、SpO2 96%。
輸血開始40分後 悪寒の訴えあり。BT 38.7℃、BP 180/102 mmHg、HR 133 /min、
SpO2 95%。
輸血開始1時間24分後 BT 40.0℃。輸血中止。
輸血中止1分後 血液培養検査実施。
輸血中止7分後 BT 40.0℃、BP 93/51 mmHg、HR 125 /min、SpO2 95%。
輸血中止56分後 補液。アセトアミノフェン 1000 mg静脈内投与。
輸血中止1時間16分後 BT 39.5℃、BP 104/63 mmHg、HR 115 /min、SpO2 97%。
輸血中止1時間24分後 BT 39.5℃。酢酸リンゲル液 500 mL 追加投与。
輸血中止3時間1分後 BT 36.3℃、BP 99 mmHg、HR 79 /min。
当該輸血用血液の残余にて細菌培養試験及びエンドトキシン試験を実
施。
細菌培養試験:陰性。
エンドトキシン試験:基準値以下。
輸血翌日 理学療法実施。
BT 36.3℃。軽快。
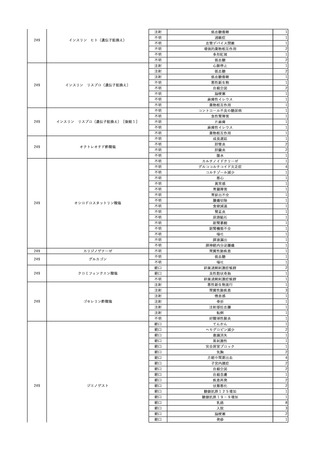
輸血6日後 輸血日実施の患者血液培養検査よりBacteroides fragilis 、Klebsiella
pneumoniae 、グラム陽性嫌気性桿菌を検出。
輸血4日前 発熱性好中球減少
症発現。セフェピム塩酸塩開
始。
5
照射濃厚血小板-LR(人
2024/2/28 血小板濃厚液(放射線照 男
射))
60 血液腫瘍
細菌性敗血症 24/02
輸血2日前 解熱。全身状態良
好。
輸血開始17分後 BT 36.6℃、BP 116/73 mmHg、HR 74 /min、SpO2 98%。
輸血開始1時間後 蕁麻疹出現。クロルフェニラミンマレイン酸塩 10 mg、ヒドロコルチゾ
ンコハク酸エステルナトリウム 100 mg投与。輸血中止。
輸血中止49分後 蕁麻疹消失し、輸血再開。
輸血再開1時間12分後 輸血終了。BT 36.9℃、BP 117/73 mmHg、HR 77 /min、SpO2
98%。
輸血翌日 BT 40.2℃、BP 122/69 mmHg、HR 104 /min、SpO2 94%。抗生剤をセフェピ
ム塩酸塩からメロペネム水和物に変更。
バイタル測定10時間後 高体温持続しておりバンコマイシン塩酸塩を追加。
当該輸血用血液の使用済みバッグ内残渣にて細菌培養試験を実施し、
血液培養検査実施。
陰性。
輸血2日後 BT 40.8℃、BP 175/91 mmHg、HR 122 /min、SpO2 98%。
輸血開始1分前 BT 36.9℃、BP
バイタル測定2時間20分後 高熱、意識レベル低下、多臓器不全。
134/75 mmHg、HR 71 /min、
バイタル測定4時間40分後 輸血翌日実施の患者血液培養検査よりBacillus cereus を
SpO2 98%。
検出。
バイタル測定6時間3分後 BT 39.7℃、BP 128/66 mmHg、HR 102 /min、SpO2 98%
(O2投与下)。
血圧低下し、昇圧剤使用するも改善せず。
バイタル測定7時間48分後 心停止。
Bacillus cereus 敗血症にて、患者死亡。剖検なし。輸血と死亡との関連性不明。
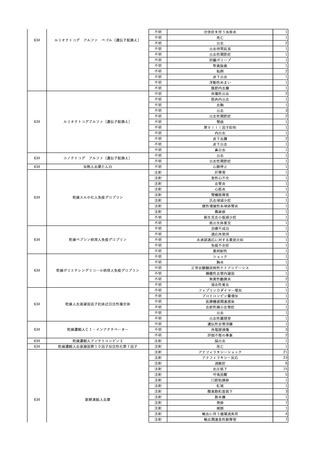
6
2024/3/5
照射赤血球液-LR(人赤
男
血球液(放射線照射))
その他の疾患
70 消化器疾患
消化器疾患
HCV-Ab(-)
(23/10)
C型肝炎
23/11
HCVコア抗原(-)
(23/11)
HCV-Ab(-)
(23/11)
HCVコア抗原(+)、HCV-Ab(-)
(24/02)
HCV-RNA(-)、HCV-Ab(-)
(23/11)
HCV-RNA(+)、HCVコア抗原(+)、HCV-Ab(-)
(24/03)
輸血開始36分後 BT 37.0℃、BP 101/63 mmHg、HR 57 /min。
輸血開始1時間25分後 頭痛あり。輸血中止。
輸血中止23分後 BT 37.3℃、BP 133/87 mmHg、HR 61 /min。
輸血中止30分後 頭痛改善なし。
輸血中止56分後 BT 37.7℃、BP 110/72 mmHg、HR 69 /min、SpO2 99%。
輸血中止2時間5分後 トイレ内にて、意識消失しているところを発見。
頭部CT検査にて、出血認めず。
数分で意識は改善するも、BP 50 mmHg台と低値。循環不全として挿管、人工呼吸器
管理。
血液培養検査実施。
メロペネム水和物、持続カテコラミン投与開始。
輸血中止2時間36分後 BP 58/38 mmHg、HR 107 /min。
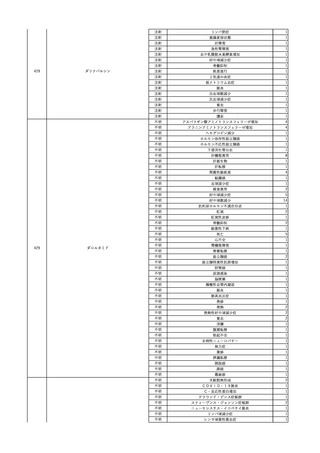
7
照射濃厚血小板-LR(人
2024/3/7 血小板濃厚液(放射線照 女
射))
30 血液疾患
劇症型溶血性
レンサ球菌感 24/03
染症
輸血前 BT 37.1℃、BP 98/65
mmHg、HR 65 /min。
HCV-RNA(+)、HCV-Ab(-)
(24/02)
輸血翌日 院内にて実施の患者血液培養検査より溶連菌を検出。
メロペネム水和物にクリンダマイシンリン酸エステルを追加投与。
血圧安定化。抜管。
輸血2日後 BT 38.5℃、BP 136/54 mmHg。
輸血3日後 BT 36.7℃、BP 116/62 mmHg。
院内にて実施の患者血液培養検査よりStreptococcus dysgalactiae を同定。
輸血4日後 BT 37.4℃、BP 113/58 mmHg。
輸血5日後 BT 37.2℃、BP 121/58 mmHg。
輸血6日後 BT 36.8℃、BP 125/77 mmHg。
8
照射濃厚血小板-LR(人
2024/3/7 血小板濃厚液(放射線照 女
射))
輸血開始後 BT 38.4℃、SpO2 88%。
輸血中止。
血液培養検査実施。
70 血液腫瘍
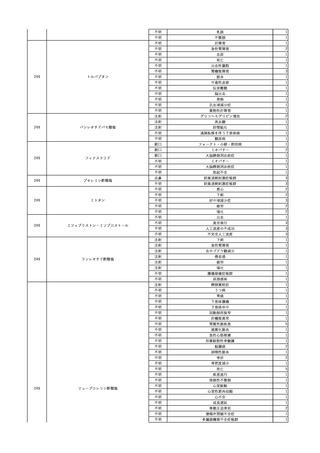
細菌感染
24/03
輸血前 BT 36.7℃、SpO2 99%。
輸血翌日 輸血日実施の患者血液培養検査よりグラム陰性桿菌検出。
輸血日実施の患者血液培養検査よりSerratia marcescens を同定。
9
2024/3/14
照射赤血球液-LR(人赤
女
血球液(放射線照射))
90 腎・泌尿器系疾患
B型肝炎
23/11
HBsAg(-)、HBeAb(-)
(23/06)
HBsAg(-)、HBsAb(+)、HBcAb(+)
(24/02)
調査中
HBV-DNA(+)
(24/03)
輸血開始14分後 BT 37.2℃、BP 153/63 mmHg、HR 65 /min、SpO2 97%。
輸血開始2時間12分後 輸血終了。BP 108/68 mmHg、HR 69 /min。
輸血中止1時間46分後 戦慄出現。
輸血中止1時間56分後 熱発あり。BT 38.7℃。
輸血中止1時間58分後 BT 38.7℃、BP 170/84 mmHg。
輸血中止3時間28分後 BT 40.1℃、BP 109/55 mmHg、HR 107 /min。
輸血中止3時間31分後 BT 40.1℃。アセトアミノフェン400 mg内服。
患者血液培養検査実施。
当該輸血用血液のセグメントチューブの血液培養検査実施。
10
2024/3/26
照射赤血球液-LR(人赤
男
血球液(放射線照射))
70 消化器腫瘍
細菌感染
24/03
輸血翌日 BT 38℃に解熱。
バイタル測定4時間後 BT 37.8℃、BP 100/61 mmHg、HR 68 /min、SpO2 97%。
輸血開始1分前 BT 36.5℃、BP
バイタル測定9時間55分後 BT 37.3℃に改善。
調査中
131/76 mmHg、HR 68 /min、
バイタル測定14時間33分後 院内にて実施の患者血液培養検査よりグラム陽性菌検
SpO2 98%。
出。セファゾリンナトリウム投与開始。
バイタル測定17時間30分後 末梢穿刺中心静脈カテーテル抜去し、カテーテル先端部
の血液培養検査実施。
輸血2日後 BT 36.9℃に解熱。
輸血3日後 白血球数改善。BT 36.4℃に改善。
院内にて実施の患者血液培養検査よりStaphylococcus epidermidis を同定。
院内にて実施のカテーテル先端部の血液培養検査よりStaphylococcus epidermidis を
同定。
院内にて実施の当該輸血用血液のセグメントチューブの血液培養検査は陰性。
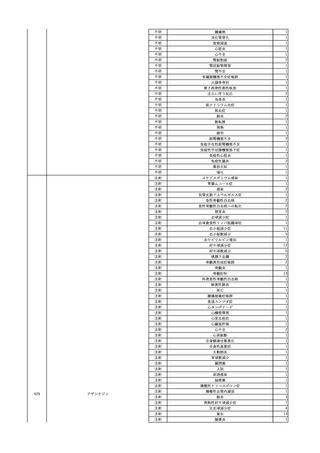
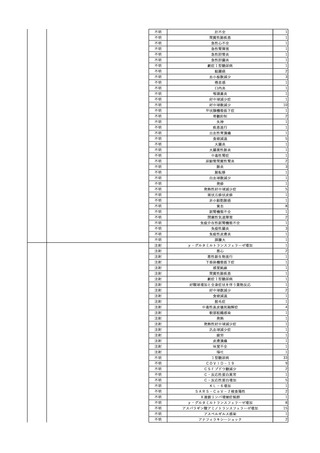
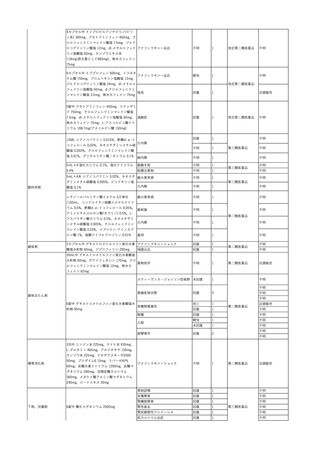
11 2023/12/25
12
13
コンコエイト-HT(乾燥濃
縮人血液凝固第8因子)
男
献血グロベニン-I(乾燥ポ
2024/2/8 リエチレングリコール処理 男
人免疫グロブリン)
献血グロベニン-I(乾燥ポ
2024/3/7 リエチレングリコール処理 男
人免疫グロブリン)
14
ベニロン-I(乾燥スルホ化
人免疫グロブリン)
2024/3/8
女
アルブミン(人血清アルブミ
ン)
15
メルスモン(胎盤絨毛分解
2024/1/4
女
物)
40 血液疾患
~10 -
80 -
その他の疾患
60
その他の疾患
60 -
HIV感染
B型肝炎コア
抗体陽性
-
-
B型肝炎表面
23/11
抗体陽性
SARS-CoV-2
検査陽性
急性B型肝炎
23/1123/12
-
-
-
乳児期に重症先天性血友病Aを発症し、薬害エイズ被害に遭った。
-
B型肝炎のスクリーニングをしたところ、HBcが陽性になった。
(不明日)
-
抗HBs抗体が上昇した。
(不明日)
-
-
-
-
-
文献からの情報。使用製剤の製造販売業者は不明であることから、自社
製品と想定し報告された。
SARS-CoV-2抗原検査陰性、
SARS-CoV-2ポリメラーゼ連鎖 投与翌日 SARS-CoV-2ポリメラーゼ連鎖反応検査陽性。
反応検査陰性
(不明日)
(不明日)
HBsAg(-)
(17/12)
-
-
-
-
-
HBsAg(+)、HBsAb(-)、HBcAb(+)、HBeAg(+)、HBeAb(+)、HBV_Taqman(5.6
LC/mL)、HBV-DNA(4.8 LIU/mL)、HBcrAg(+)、HBc-IgM-Ab(+)、HBVジェノタイプ
(C)
(23/12)
-
-
-
417
平成11年8月30日付医薬発第1047号厚生省医薬安全局長通知「血漿分
画製剤のウイルスに対する安全性確保に関するガイドラインについて」に
従って行ったウイルスプロセスバリデーションにより、10^9以上の除去・不
活化ができることが検証されている工程で製造されている。
Lot No.G22703及びLot No. G23328について社内保存品のNAT検査は、い
ずれも陰性であった。