よむ、つかう、まなぶ。
議題1 患-1患者申出療養の総括報告書に関する評価について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40866.html |
| 出典情報 | 患者申出療養評価会議(第51回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
切除不能/転移性固形腫瘍にもダブラフェニブとトラメチニブの
併用療法の承認適応が拡大され、対象年齢として、6歳以上の
小児も追加された。
以上のことから、小児のBRAFV600変異を有する神経膠腫に
対しても、効果が期待される。
なお、我が国では、2022年3月に、ダブラフェニブとトラメチニ
ブがBRAFV600遺伝子変異を有する進行・再発の固形腫瘍に
対し、希少疾病用医薬品に指定された。
医療技術の試験結果
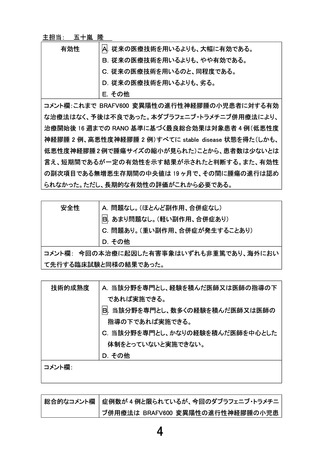
安全性の評価結果:
重篤な有害事象として、感染性腸炎が 1 件発生したが、本
試験薬との因果関係はないと判断された。その他の有害事象
は全て非重篤であった。
有効性の評価結果:
主要評価項目である投与開始後 16 週までの最良総合効果
は、4 例(低悪性度神経膠腫 2 例、高悪性度神経膠腫 2 例)全
例で stable disease(SD)であった。
本試験薬の保険適用拡大に伴う本患者申出療養取下げ(令
和 5 年 11 月 24 日)時点で、低悪性度神経膠腫を有する患者
2 例は投与開始後 52 週時点の有効性評価を完了していた。
両症例とも、試験期間中に腫瘍サイズの縮小を認め、1 例は
52 週時点で partial response(PR)となった。もう 1 例は SD で
あり、腫瘍に起因すると考えられる嗄声、しゃっくりの改善を認
めた。
高悪性度神経膠腫を有する患者については、1 例は投与開
始後 78 週時点、もう 1 例は投与開始後 52 週時点の有効性評
価を完了しており、両症例で SD を継続していた。
発生した有害事象(累計):
Grade3:好中球減少、感染性腸炎
各1件
Grade2:感冒、結節性紅斑
各2件
発熱、症候性てんかん、うおのめ、咽頭炎
じんましん、イレウス
Grade1:発熱
各1件
7件
2
併用療法の承認適応が拡大され、対象年齢として、6歳以上の
小児も追加された。
以上のことから、小児のBRAFV600変異を有する神経膠腫に
対しても、効果が期待される。
なお、我が国では、2022年3月に、ダブラフェニブとトラメチニ
ブがBRAFV600遺伝子変異を有する進行・再発の固形腫瘍に
対し、希少疾病用医薬品に指定された。
医療技術の試験結果
安全性の評価結果:
重篤な有害事象として、感染性腸炎が 1 件発生したが、本
試験薬との因果関係はないと判断された。その他の有害事象
は全て非重篤であった。
有効性の評価結果:
主要評価項目である投与開始後 16 週までの最良総合効果
は、4 例(低悪性度神経膠腫 2 例、高悪性度神経膠腫 2 例)全
例で stable disease(SD)であった。
本試験薬の保険適用拡大に伴う本患者申出療養取下げ(令
和 5 年 11 月 24 日)時点で、低悪性度神経膠腫を有する患者
2 例は投与開始後 52 週時点の有効性評価を完了していた。
両症例とも、試験期間中に腫瘍サイズの縮小を認め、1 例は
52 週時点で partial response(PR)となった。もう 1 例は SD で
あり、腫瘍に起因すると考えられる嗄声、しゃっくりの改善を認
めた。
高悪性度神経膠腫を有する患者については、1 例は投与開
始後 78 週時点、もう 1 例は投与開始後 52 週時点の有効性評
価を完了しており、両症例で SD を継続していた。
発生した有害事象(累計):
Grade3:好中球減少、感染性腸炎
各1件
Grade2:感冒、結節性紅斑
各2件
発熱、症候性てんかん、うおのめ、咽頭炎
じんましん、イレウス
Grade1:発熱
各1件
7件
2