よむ、つかう、まなぶ。
議題1 患-1患者申出療養の総括報告書に関する評価について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40866.html |
| 出典情報 | 患者申出療養評価会議(第51回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
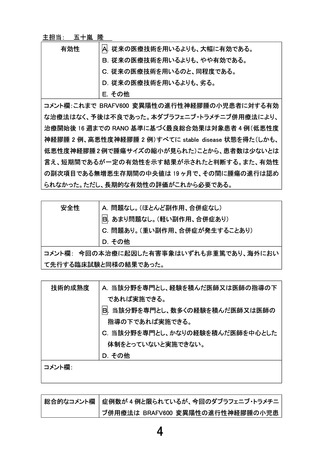
感冒、結節性紅斑、ざそう様皮疹
各2件
口腔内粘膜炎、嘔吐、便秘、皮疹、湿疹、側弯症
COVID-19 感染症
各1件
上記のうち、重篤な有害事象の発生:
感染性腸炎(Grade3)
1件
結論:
ダブラフェニブ、トラメチニブの投与により、進行性の低悪性
度神経膠腫の腫瘍サイズの縮小や症状の改善を認めたこと、
また、予後の悪い高悪性度神経膠腫が本研究期間中、stable
disease を保っていたことから本試験薬の有効性が示唆され
た。
重篤な有害事象の発生は 1 件であり、試験薬との因果関係
はなしと判断され、その他の有害事象は全て非重篤であった。
多く報告された有害事象は発熱、皮膚毒性であり、先行した以
下の臨床試験の安全性の結果と整合性のある結果であった。
・BRAFV600 変異を有する進行悪性腫瘍等を有する小児(生後
1 ヶ月以上 18 歳未満)を対象とした海外第 I/II 相試験
(NCT02124772)パート D(進行・再発の低悪性度神経膠腫患者
20 例、再発または難治性のランゲルハンス細胞組織球症患者
10 例)
・BRAFV600 変異を有する小児神経膠腫患者を対象とした国
際共同第Ⅱ相試験(NCT02684058)
以上より、本患者申出療養で、日本人の小児神経膠腫患者
に対しダブラフェニブ、トラメチニブが有効かつ安全である可能
性が示された。
臨床研究登録ID
jRCTs071210071
3
各2件
口腔内粘膜炎、嘔吐、便秘、皮疹、湿疹、側弯症
COVID-19 感染症
各1件
上記のうち、重篤な有害事象の発生:
感染性腸炎(Grade3)
1件
結論:
ダブラフェニブ、トラメチニブの投与により、進行性の低悪性
度神経膠腫の腫瘍サイズの縮小や症状の改善を認めたこと、
また、予後の悪い高悪性度神経膠腫が本研究期間中、stable
disease を保っていたことから本試験薬の有効性が示唆され
た。
重篤な有害事象の発生は 1 件であり、試験薬との因果関係
はなしと判断され、その他の有害事象は全て非重篤であった。
多く報告された有害事象は発熱、皮膚毒性であり、先行した以
下の臨床試験の安全性の結果と整合性のある結果であった。
・BRAFV600 変異を有する進行悪性腫瘍等を有する小児(生後
1 ヶ月以上 18 歳未満)を対象とした海外第 I/II 相試験
(NCT02124772)パート D(進行・再発の低悪性度神経膠腫患者
20 例、再発または難治性のランゲルハンス細胞組織球症患者
10 例)
・BRAFV600 変異を有する小児神経膠腫患者を対象とした国
際共同第Ⅱ相試験(NCT02684058)
以上より、本患者申出療養で、日本人の小児神経膠腫患者
に対しダブラフェニブ、トラメチニブが有効かつ安全である可能
性が示された。
臨床研究登録ID
jRCTs071210071
3