よむ、つかう、まなぶ。
参考資料10 新型コロナワクチン「ダイチロナ筋注」(第一三共株式会社)添付文書[4.2MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
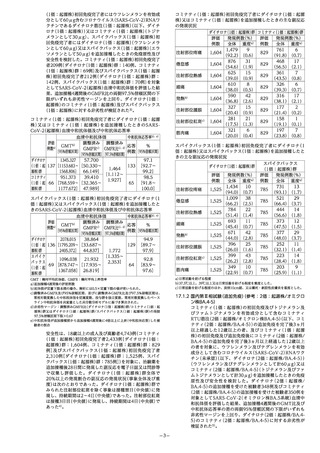
9.1.1 皿小板減少症又は導固障害を有する者、抗凝固療法を
内央明による曲霞を最小限に抑えること。 直射日光及
施行している者 び紫外線が当たらないようにすること。
本剤接種後に出血又は注射部位に内出血があらわれる 14.1.2 本剤1バイアルには2回接種分(1回0.6mL)が含まれる。
おそれがある。 14.1.3 使用前に、白色の均一な液になるまでゆっくり転倒混
9.1.2 過去に免疫不全の診断がなされている者及び近親者に 和すること。 振り混ぜないこと。 転倒混和後に、変色、
先天性免疫不全症の者がいる者 異物その他の異常がなないことを目視により確認するこ
本剤に対する免疫応答が低下するおそれがある。
9.1.3 心臓血管系疾患、腎臓活患、肝臓疾患、皿液疾患、発
育障害等の基礎疾患を有する者
[9.2、9.3 参照]
9.1.4 予防接種で接種後2日以内に発熱のみられた者及び全身
性発疹等のアレルギーを疑う症状を呈したことがある者
9.1.5 過去にけいれんの既往のある者
9.1.6 本剤の成分に対して、アレルギーを呈するおそれのあ
と。 異常を認めたものは使用しないこと。
14.1.4 吸引の際には容器の栓及びその周囲をアルコールで消
毒すること。また、注射鑑をさし込み、所要量を吸引
すること。この操作に当たっては、雑菌が混入しない
よう注意すること。
14.1.5 稚を取り外し、あるいは他の容器に移し使用しないこと。
14.1.6 保存剤を含まないため、一度針を刺したバイアルは2~
8Cで保存し、24時間以内に使用すること。使用時には
る者 冷蔵庫から取り出し常温になってから直ちに合用する
[8.4、11.1.1 参照] こと。
9.2 腎機能障害を有する者 14.2 薬剤接種時の注意
接種要注意者である。[9.1.3 参照] 14.2.1 接種用器具は、ガンマ線等により滅菌されたディス
9.3 肝機能障害を有する者 ポーザブル品を用い、被接種者ごどとに取り換えること。
接種要注意者である。[9.1.3 参照] *14.2.2 本剤を他のワクチンと混合して接種しないこと。[7.4
9.5 妊婦 参照]
妊婦又は妊娠している可能性のある女性には予防接種上
の有益性が危険性を上回ると判断される場合にのみ接種
すること。
14.2.3 通常、三角筋に筋肉内接種すること。 静脈内、皮内、
皮下への接種は行わないこと。
14.2.4 注射針の先端が血管内に入っていないことを確かめる
9.6 授乳婦 こと。
予防接種上の有益性及び母乳栄養の有益性を考慮し、授 14.2.5 組織・神経等への影響を避けるため次の点に注意する
乳の継続又は中止を検討すること。ヒト乳汁中への移行 こと。
は不明である。 ・針長は筋肉内接種に足る長さで、神経、血管、骨等の
9.7 小児等 筋肉下組織に到達しないよう、各和被接種者に対して適
12歳未満を対象とした際床試験は実施していない。 切な針長を決定すること。
9.8 高齢者 ・神経走行部位を避けること。
接種に当たっては、問診等を慎重に行い、被接種者の健
康状態を十分に観察すること。 一般に、生理機能が低下
している。
・注射針を刺入したとき、激痛の訴えや血液の逆流がみ
られた場合は直ちに針を抜き、部位をかえて注射する
こと。
11. 副反応
次の副反応があらわれることがあるので、和観察を十分に行い、
15. その他の注意
15.1 臨床使用に基づく情報
異常が認められた場合には適切な処置を行うこと。
11.1 重大な副反応
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
[2.3、8.4、9.1.6 参照]
11.1.2 心筋災(頻度不明)、心膜炎(頻度不明)
[8.6、15.1.1、15.1.2 参照]
11.2 その他の副反応
注1)臨床試験において電子日誌により収集した副反応を含む発現頻度
注2)接種後7日目以降にあらわれることがある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 冷蔵庫から取り出し常温になってから合用すること。
冷蔵庫から取り出してから12時間以内に使用すること。
なお、1回に限り再度冷蔵庫に戻し最大で24時間保存す
ることができるが、使用時には冷蔵庫から取り出し常
温になってから直ちに使用すること。使用するまで室
*15.1.1 海外において、コロナウイルス(SARS-CoV-2)RNAワ
クチン接種後に心筋炎、心膜炎が報告されている。過
去にSARS-CoV-2ワクチンの接種歴のない者に対する2
回目までの接種において報告された症例の多くは若年
男性であり、特に2回目接種後数日以内に発現している。
また、大多数の症例で、入院による安静陰床により症
状が改善しているリ。[8.6、11.1.2 参照]
10%以上 1 10%未満 1%未満 *15.1.2 コロナウイルス(SARS-CoV-2)RNAワクチンの国内副
局所症状 次痛けり(92.1%)、|遅発性反応2?(紅 ]発疹、リン 反応疑い報告における心筋炎、心膜炎の報告率と、
(注射部位) |熱感まり (43.6%) 、|斑、腫須、そう疾|パ節腫妥 内の医療情報データベースを用いて算出した一般集団
腫服きり、紅斑まきり、|感、熱感、硬結、 から推測される心筋炎、心膜炎の発現率とを比較した
そう着感まり、硬 |湊痛) ところ、過去にSARS-CoV-2ワクチンの接種歴のない
結きり) 者に対する2回接種後の若年男性で頻度が高いことが示
血液 リンパ節症 リンパ節痛、 唆された?。[8.6、11.1.2 参照]
リンパ館炎 15.1.3 海外において、度膚充填剤との関連性は不明であるが、
精神神経系 頭痛) (37.4%) 感覚鈍麻、 皮膚充填剤注入歴のある被接種者において、コロナウイ
傾服 ルス(SARS-CoV-2)RNAワクチン接種後に、皮膚充填
消化界 嘱吐・嘱気、 剤注入部位周辺の腫服(特に顔面腫有)が報告されている。
下痢
amn 17.此床成績
人 発疹 sn | *17.1 有効性及び安全性に関する試験
ない 家にコミナティ パ
その他 介感(5.2%%)、須和痛 加朱 バックス筋注を4週間隔で2回接種すること、「追加免疫]とは、
発熱"35.0%) 初回免湊完了者を対象に3回目以降のコロナウイルス(SARS-
CoV-2)RNAワクチンを追加接種することである。
17.1.1 国内第 I //息相試験 (追加免疫) (参考 : ダイチロナ筋注
(1価 : 起源株) )
トジナメランを有効成分として含むコロナウイルス(SARS-
CoV-2)RNAワクチンであるコミナティ筋注(1価 : 起源株)
(以下、コミナティ(1価 : 起源株))又はエラソメランを有効
成分として含むコロナウイルス (SARS-CoV-2)RNAワクチ
ンであるスパイクバックス筋注(1価 : 起源株) (以下、スパ
イクバックス(]価 : 起源株))の初回免疫を完了後6ヵ月以上
経過した18歳以上の成人及び高齢者を対象に、コミナティ
内央明による曲霞を最小限に抑えること。 直射日光及
施行している者 び紫外線が当たらないようにすること。
本剤接種後に出血又は注射部位に内出血があらわれる 14.1.2 本剤1バイアルには2回接種分(1回0.6mL)が含まれる。
おそれがある。 14.1.3 使用前に、白色の均一な液になるまでゆっくり転倒混
9.1.2 過去に免疫不全の診断がなされている者及び近親者に 和すること。 振り混ぜないこと。 転倒混和後に、変色、
先天性免疫不全症の者がいる者 異物その他の異常がなないことを目視により確認するこ
本剤に対する免疫応答が低下するおそれがある。
9.1.3 心臓血管系疾患、腎臓活患、肝臓疾患、皿液疾患、発
育障害等の基礎疾患を有する者
[9.2、9.3 参照]
9.1.4 予防接種で接種後2日以内に発熱のみられた者及び全身
性発疹等のアレルギーを疑う症状を呈したことがある者
9.1.5 過去にけいれんの既往のある者
9.1.6 本剤の成分に対して、アレルギーを呈するおそれのあ
と。 異常を認めたものは使用しないこと。
14.1.4 吸引の際には容器の栓及びその周囲をアルコールで消
毒すること。また、注射鑑をさし込み、所要量を吸引
すること。この操作に当たっては、雑菌が混入しない
よう注意すること。
14.1.5 稚を取り外し、あるいは他の容器に移し使用しないこと。
14.1.6 保存剤を含まないため、一度針を刺したバイアルは2~
8Cで保存し、24時間以内に使用すること。使用時には
る者 冷蔵庫から取り出し常温になってから直ちに合用する
[8.4、11.1.1 参照] こと。
9.2 腎機能障害を有する者 14.2 薬剤接種時の注意
接種要注意者である。[9.1.3 参照] 14.2.1 接種用器具は、ガンマ線等により滅菌されたディス
9.3 肝機能障害を有する者 ポーザブル品を用い、被接種者ごどとに取り換えること。
接種要注意者である。[9.1.3 参照] *14.2.2 本剤を他のワクチンと混合して接種しないこと。[7.4
9.5 妊婦 参照]
妊婦又は妊娠している可能性のある女性には予防接種上
の有益性が危険性を上回ると判断される場合にのみ接種
すること。
14.2.3 通常、三角筋に筋肉内接種すること。 静脈内、皮内、
皮下への接種は行わないこと。
14.2.4 注射針の先端が血管内に入っていないことを確かめる
9.6 授乳婦 こと。
予防接種上の有益性及び母乳栄養の有益性を考慮し、授 14.2.5 組織・神経等への影響を避けるため次の点に注意する
乳の継続又は中止を検討すること。ヒト乳汁中への移行 こと。
は不明である。 ・針長は筋肉内接種に足る長さで、神経、血管、骨等の
9.7 小児等 筋肉下組織に到達しないよう、各和被接種者に対して適
12歳未満を対象とした際床試験は実施していない。 切な針長を決定すること。
9.8 高齢者 ・神経走行部位を避けること。
接種に当たっては、問診等を慎重に行い、被接種者の健
康状態を十分に観察すること。 一般に、生理機能が低下
している。
・注射針を刺入したとき、激痛の訴えや血液の逆流がみ
られた場合は直ちに針を抜き、部位をかえて注射する
こと。
11. 副反応
次の副反応があらわれることがあるので、和観察を十分に行い、
15. その他の注意
15.1 臨床使用に基づく情報
異常が認められた場合には適切な処置を行うこと。
11.1 重大な副反応
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
[2.3、8.4、9.1.6 参照]
11.1.2 心筋災(頻度不明)、心膜炎(頻度不明)
[8.6、15.1.1、15.1.2 参照]
11.2 その他の副反応
注1)臨床試験において電子日誌により収集した副反応を含む発現頻度
注2)接種後7日目以降にあらわれることがある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 冷蔵庫から取り出し常温になってから合用すること。
冷蔵庫から取り出してから12時間以内に使用すること。
なお、1回に限り再度冷蔵庫に戻し最大で24時間保存す
ることができるが、使用時には冷蔵庫から取り出し常
温になってから直ちに使用すること。使用するまで室
*15.1.1 海外において、コロナウイルス(SARS-CoV-2)RNAワ
クチン接種後に心筋炎、心膜炎が報告されている。過
去にSARS-CoV-2ワクチンの接種歴のない者に対する2
回目までの接種において報告された症例の多くは若年
男性であり、特に2回目接種後数日以内に発現している。
また、大多数の症例で、入院による安静陰床により症
状が改善しているリ。[8.6、11.1.2 参照]
10%以上 1 10%未満 1%未満 *15.1.2 コロナウイルス(SARS-CoV-2)RNAワクチンの国内副
局所症状 次痛けり(92.1%)、|遅発性反応2?(紅 ]発疹、リン 反応疑い報告における心筋炎、心膜炎の報告率と、
(注射部位) |熱感まり (43.6%) 、|斑、腫須、そう疾|パ節腫妥 内の医療情報データベースを用いて算出した一般集団
腫服きり、紅斑まきり、|感、熱感、硬結、 から推測される心筋炎、心膜炎の発現率とを比較した
そう着感まり、硬 |湊痛) ところ、過去にSARS-CoV-2ワクチンの接種歴のない
結きり) 者に対する2回接種後の若年男性で頻度が高いことが示
血液 リンパ節症 リンパ節痛、 唆された?。[8.6、11.1.2 参照]
リンパ館炎 15.1.3 海外において、度膚充填剤との関連性は不明であるが、
精神神経系 頭痛) (37.4%) 感覚鈍麻、 皮膚充填剤注入歴のある被接種者において、コロナウイ
傾服 ルス(SARS-CoV-2)RNAワクチン接種後に、皮膚充填
消化界 嘱吐・嘱気、 剤注入部位周辺の腫服(特に顔面腫有)が報告されている。
下痢
amn 17.此床成績
人 発疹 sn | *17.1 有効性及び安全性に関する試験
ない 家にコミナティ パ
その他 介感(5.2%%)、須和痛 加朱 バックス筋注を4週間隔で2回接種すること、「追加免疫]とは、
発熱"35.0%) 初回免湊完了者を対象に3回目以降のコロナウイルス(SARS-
CoV-2)RNAワクチンを追加接種することである。
17.1.1 国内第 I //息相試験 (追加免疫) (参考 : ダイチロナ筋注
(1価 : 起源株) )
トジナメランを有効成分として含むコロナウイルス(SARS-
CoV-2)RNAワクチンであるコミナティ筋注(1価 : 起源株)
(以下、コミナティ(1価 : 起源株))又はエラソメランを有効
成分として含むコロナウイルス (SARS-CoV-2)RNAワクチ
ンであるスパイクバックス筋注(1価 : 起源株) (以下、スパ
イクバックス(]価 : 起源株))の初回免疫を完了後6ヵ月以上
経過した18歳以上の成人及び高齢者を対象に、コミナティ