よむ、つかう、まなぶ。
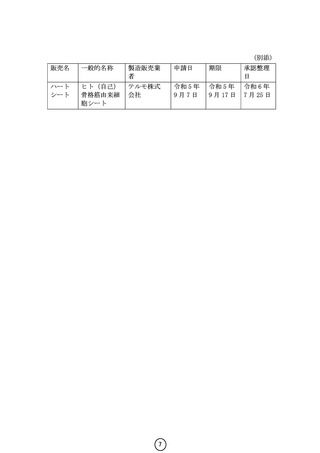
総-7-2薬事審議会 再生医療等製品・生物由来技術部会におけるハートシートの審議の概要について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42059.html |
| 出典情報 | 中央社会保険医療協議会 総会(第593回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中医協
総-7-2
6
8
.
.
薬事審議会 再生医療等製品・生物由来技術部会 における
ハートシートの審議の概要について
令和6年7月 19 日(金)
令和6年7月 19 日に開催された薬事審議会 再生医療等製品・生物由来技術部会におい
て審議されたハートシート(以下、「本品」という。)について、審議の概要は以下のとおりです。
1.主な議論と審議結果
1)使用成績調査及び臨床研究の結果
<主要評価項目>
心臓疾患関連死
<重要な副次評価項目>
・いずれかの重大な心血管イベントによる入院の発生までの期間
・本品移植後6ヶ月において LVEF が本品移植時より5%以上改善した症例の割合
<症例登録数/有効性解析対象集団数>
本品群:使用成績調査 67 例/49 例
対照群(参照群)
:臨床研究
104 例/102 例
<評価結果>
参照した臨床研究のデータが外部対照であり、調整を行ってもなお両群の比較に
は限界があるものの、主要評価項目である心臓疾患関連死までの期間について、
本品群の対照群(参照群)に対する優越性は示されなかった。
副次評価項目である心機能に関する LVEF の改善などでも、本品群で対照群(参照
群)より優れた結果は認められなかった。
安全性については、条件及び期限付承認時に確認されたリスクや有害事象を超え
る新たな懸念は認められないものの、本品の有効性が示されていないことから、
ベネフィットリスクの観点から許容可能とは言えない。
2)結論
有効性が推定されるとした条件及び期限付承認時の判断は否定されないものの、本
品の条件及び期限付承認後に実施された使用成績調査及び臨床研究の検討結果からは、
本品の「効能・効果又は性能」に対する有効性は示されておらず、薬機法第 23 条の 25
第 2 項第 3 号イ「申請に係る効能、効果又は性能を有すると認められないとき。
」に該
当すると考えるため、同法第 23 条の 25 第1項の規定に基づき本品を承認することは
適切ではない。
1
7
総-7-2
6
8
.
.
薬事審議会 再生医療等製品・生物由来技術部会 における
ハートシートの審議の概要について
令和6年7月 19 日(金)
令和6年7月 19 日に開催された薬事審議会 再生医療等製品・生物由来技術部会におい
て審議されたハートシート(以下、「本品」という。)について、審議の概要は以下のとおりです。
1.主な議論と審議結果
1)使用成績調査及び臨床研究の結果
<主要評価項目>
心臓疾患関連死
<重要な副次評価項目>
・いずれかの重大な心血管イベントによる入院の発生までの期間
・本品移植後6ヶ月において LVEF が本品移植時より5%以上改善した症例の割合
<症例登録数/有効性解析対象集団数>
本品群:使用成績調査 67 例/49 例
対照群(参照群)
:臨床研究
104 例/102 例
<評価結果>
参照した臨床研究のデータが外部対照であり、調整を行ってもなお両群の比較に
は限界があるものの、主要評価項目である心臓疾患関連死までの期間について、
本品群の対照群(参照群)に対する優越性は示されなかった。
副次評価項目である心機能に関する LVEF の改善などでも、本品群で対照群(参照
群)より優れた結果は認められなかった。
安全性については、条件及び期限付承認時に確認されたリスクや有害事象を超え
る新たな懸念は認められないものの、本品の有効性が示されていないことから、
ベネフィットリスクの観点から許容可能とは言えない。
2)結論
有効性が推定されるとした条件及び期限付承認時の判断は否定されないものの、本
品の条件及び期限付承認後に実施された使用成績調査及び臨床研究の検討結果からは、
本品の「効能・効果又は性能」に対する有効性は示されておらず、薬機法第 23 条の 25
第 2 項第 3 号イ「申請に係る効能、効果又は性能を有すると認められないとき。
」に該
当すると考えるため、同法第 23 条の 25 第1項の規定に基づき本品を承認することは
適切ではない。
1
7