よむ、つかう、まなぶ。
総-7-2薬事審議会 再生医療等製品・生物由来技術部会におけるハートシートの審議の概要について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42059.html |
| 出典情報 | 中央社会保険医療協議会 総会(第593回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医薬機審発 0725 第1号
令和6年7月 25 日
各都道府県衛生主管部(局)長 殿
厚生労働省医薬局医療機器審査管理課長
(
公
印
省
略
)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
第 23 条の 26 第1項の規定に基づき条件及び期限付承認された再生医
療等製品の承認整理について
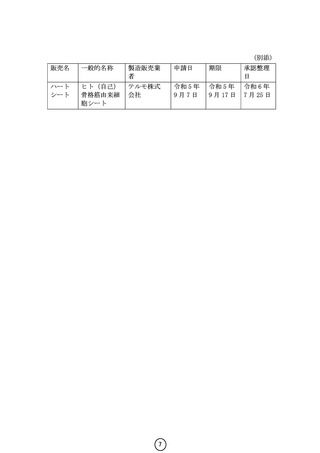
今般、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法
律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」という。) 第 23 条
の 26 第5項の規定に基づきテルモ株式会社(以下「同社」という。)から改
めて申請のあった再生医療等製品「ハートシート」(以下「本品」という。)
については、「再生医療等製品「ハートシート」の取扱いについて」(令和
6年7月 24 日付け医薬機審発 0724 第2号厚生労働省医薬局医療機器審査管理
課長通知)において、可能な限りすみやかに承認整理を行わせる旨をお示し
したところですが、今般、別添のとおり、同社から本品に係る承認整理の届
書が提出されましたので、御了知の上、関係各方面に対して周知方御配慮願
います。
6
令和6年7月 25 日
各都道府県衛生主管部(局)長 殿
厚生労働省医薬局医療機器審査管理課長
(
公
印
省
略
)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
第 23 条の 26 第1項の規定に基づき条件及び期限付承認された再生医
療等製品の承認整理について
今般、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法
律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」という。) 第 23 条
の 26 第5項の規定に基づきテルモ株式会社(以下「同社」という。)から改
めて申請のあった再生医療等製品「ハートシート」(以下「本品」という。)
については、「再生医療等製品「ハートシート」の取扱いについて」(令和
6年7月 24 日付け医薬機審発 0724 第2号厚生労働省医薬局医療機器審査管理
課長通知)において、可能な限りすみやかに承認整理を行わせる旨をお示し
したところですが、今般、別添のとおり、同社から本品に係る承認整理の届
書が提出されましたので、御了知の上、関係各方面に対して周知方御配慮願
います。
6