よむ、つかう、まなぶ。
総-7-2薬事審議会 再生医療等製品・生物由来技術部会におけるハートシートの審議の概要について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42059.html |
| 出典情報 | 中央社会保険医療協議会 総会(第593回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.今後の予定
薬事審議会において、本品の製造販売承認の可否等を審議する予定。
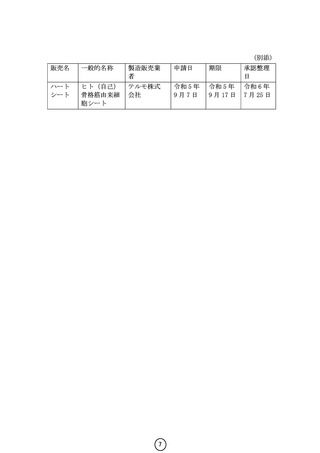
《参考》製品概要
販売名
製造販売業者
承認年月日
承認期限
製品概要
ハートシート
テルモ株式会社
平成 27 年 9 月 18 日(条件及び期限付承認)
5年、後に3年延長(令和 5 年 9 月 17 日)
本品は、虚血性心疾患で重症心不全となった患者の治療を目的とし
て、医療機関において患者自身から採取した骨格筋に含まれる骨格
筋芽細胞を製造所において培養して増殖させた後に、専用容器に充
填して凍結保存したものを医療機関においてシート状に調製し、患
者の心臓表面に5枚を移植して使用 する再生医療等製品である。
承認効能・効 下記の基準のすべてを満たす、薬物治療や侵襲的治療を含む標準治
果又は性能
療で効果不十分な虚血性心疾患による重症心不全の治療
<対象とする心不全の状態>
・NYHA 心機能分類がⅢ又はⅣ度
・安静時における左室駆出率が 35%以下
2
薬事審議会において、本品の製造販売承認の可否等を審議する予定。
《参考》製品概要
販売名
製造販売業者
承認年月日
承認期限
製品概要
ハートシート
テルモ株式会社
平成 27 年 9 月 18 日(条件及び期限付承認)
5年、後に3年延長(令和 5 年 9 月 17 日)
本品は、虚血性心疾患で重症心不全となった患者の治療を目的とし
て、医療機関において患者自身から採取した骨格筋に含まれる骨格
筋芽細胞を製造所において培養して増殖させた後に、専用容器に充
填して凍結保存したものを医療機関においてシート状に調製し、患
者の心臓表面に5枚を移植して使用 する再生医療等製品である。
承認効能・効 下記の基準のすべてを満たす、薬物治療や侵襲的治療を含む標準治
果又は性能
療で効果不十分な虚血性心疾患による重症心不全の治療
<対象とする心不全の状態>
・NYHA 心機能分類がⅢ又はⅣ度
・安静時における左室駆出率が 35%以下
2