よむ、つかう、まなぶ。
【資料1】改正再生医療等安全性確保法におけるワクチンの扱いについて (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41827.html |
| 出典情報 | 厚生科学審議会 感染症部会(第88回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
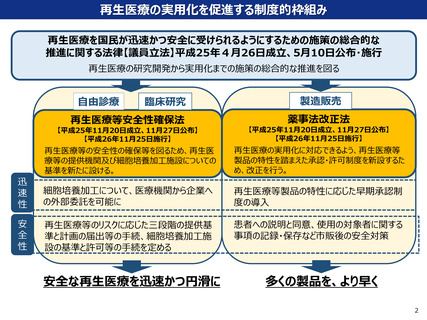
改正後再生医療等安全性確保法におけるワクチンの扱いの位置づけ
○ in vivo遺伝子治療等や遺伝子治療等の関連技術には、人の疾病の予防を目的とする、核酸等を用いたワ
クチン(mRNAワクチンなど)も含まれ、当該ワクチンのうち、薬事承認を受けていないものについては、
その接種に当たり、法に基づき提供計画の提出等が義務付けられることとなる。
○ 他方、ワクチンについては、公衆衛生上、感染症対策として迅速な使用が求められるものが想定される。
今般の制度見直しに向けた厚生科学審議会再生医療等評価部会においては、こうしたものについて、一律に
法において提供計画の提出等を求めることは適切ではないとの結論が示された。
「再生医療等安全性確保法施行5年後の 見直しに係る検討のとりまとめ」抜粋
(令和4年6月3日厚生科学審議会再生医療等評価部会)
<遺伝子治療・関連技術を用いたワクチンの扱い>
○ in vivo 遺伝子治療のうち、疾病の予防を目的とするものについても、細胞医療(ex vivo 遺伝子治療を含
む)と同様に再生医療等安全性確保法の対象となるという点で概ね意見が一致した。
(中略)
○ 日本未承認であるが外国で承認されている感染症の予防(感染・発症 予防や重症化予防等を含む)を目的
としたワクチンについては、公衆衛生施策上必要なものは再生医療等安全性確保法上、個別に除くという
点で概ね意見が一致した。
6
○ in vivo遺伝子治療等や遺伝子治療等の関連技術には、人の疾病の予防を目的とする、核酸等を用いたワ
クチン(mRNAワクチンなど)も含まれ、当該ワクチンのうち、薬事承認を受けていないものについては、
その接種に当たり、法に基づき提供計画の提出等が義務付けられることとなる。
○ 他方、ワクチンについては、公衆衛生上、感染症対策として迅速な使用が求められるものが想定される。
今般の制度見直しに向けた厚生科学審議会再生医療等評価部会においては、こうしたものについて、一律に
法において提供計画の提出等を求めることは適切ではないとの結論が示された。
「再生医療等安全性確保法施行5年後の 見直しに係る検討のとりまとめ」抜粋
(令和4年6月3日厚生科学審議会再生医療等評価部会)
<遺伝子治療・関連技術を用いたワクチンの扱い>
○ in vivo 遺伝子治療のうち、疾病の予防を目的とするものについても、細胞医療(ex vivo 遺伝子治療を含
む)と同様に再生医療等安全性確保法の対象となるという点で概ね意見が一致した。
(中略)
○ 日本未承認であるが外国で承認されている感染症の予防(感染・発症 予防や重症化予防等を含む)を目的
としたワクチンについては、公衆衛生施策上必要なものは再生医療等安全性確保法上、個別に除くという
点で概ね意見が一致した。
6