よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件見直しについて (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
臨床研究中核病院の医療法での位置づけについて
現状の臨床研究中核病院制度にかかる概要
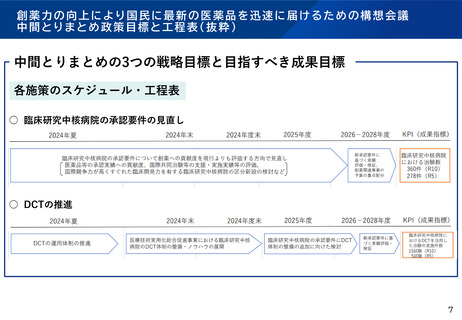
○ 日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床研究を推進するため、国際水準の臨床研究
や医師主導治験の中心的役割を担う病院を臨床研究中核病院として医療法上に位置づけ(平成27年4月施行)。
※ 臨床研究は、医療行為を行いながら、医療における疾病の予防、診断並びに治療の方法の改善、疾病の原因及び病態の理解
に関する研究を同時に行うものであり、臨床研究の推進は、良質な医療の提供に資するものであるため、医療法の趣旨に合致
する。
○ 質の高い臨床研究を実施する病院を厚生労働大臣が臨床研究中核病院として承認し、名称を独占することで、
・ 臨床研究中核病院が、他の医療機関の臨床研究の実施をサポートし、また、共同研究を行う場合にあっては中核となって臨床
研究を実施することで、他の医療機関における臨床研究の質の向上が図られる
・ 臨床研究に参加を希望する患者が、質の高い臨床研究を行う病院を把握した上で当該病院へアクセスできるようになる
・ 患者を集約し、十分な管理体制の下で診療データの収集等を行うことで、臨床研究が集約的かつ効率的に行われるようにな
る
ことにより、質の高い臨床研究を推進し、次世代のより良質な医療の提供を可能にすることを目的としている。
○ 臨床研究中核病院には、医療技術実用化総合促進事業と臨床研究総合促進事業において、令和6年度は、
合計:約31億円(1医療機関あたり約2億円)を補助している。
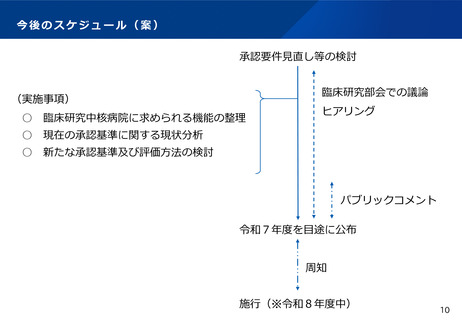
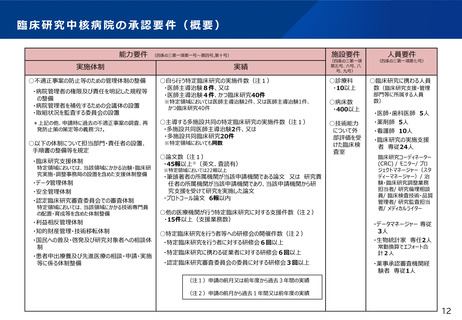
○ 一定の組織体制・能力に係る基準を満たした病院について、厚生労働大臣が社会保障審議会の意見を聴いた上で、臨
床研究中核病院として承認する。令和6年9月現在、下記の15病院が承認されている。
・国立がん研究センター中央病院
・京都大学医学部附属病院
・東北大学病院
・千葉大学医学部附属病院
・順天堂大学医学部附属順天堂医院
・名古屋大学医学部附属病院
・北海道大学病院
・東京大学医学部附属病院
・九州大学病院
・神戸大学医学部附属病院
・国立がん研究センター東病院
・大阪大学医学部附属病院
・岡山大学病院
・慶應義塾大学病院
・長崎大学病院
2
現状の臨床研究中核病院制度にかかる概要
○ 日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床研究を推進するため、国際水準の臨床研究
や医師主導治験の中心的役割を担う病院を臨床研究中核病院として医療法上に位置づけ(平成27年4月施行)。
※ 臨床研究は、医療行為を行いながら、医療における疾病の予防、診断並びに治療の方法の改善、疾病の原因及び病態の理解
に関する研究を同時に行うものであり、臨床研究の推進は、良質な医療の提供に資するものであるため、医療法の趣旨に合致
する。
○ 質の高い臨床研究を実施する病院を厚生労働大臣が臨床研究中核病院として承認し、名称を独占することで、
・ 臨床研究中核病院が、他の医療機関の臨床研究の実施をサポートし、また、共同研究を行う場合にあっては中核となって臨床
研究を実施することで、他の医療機関における臨床研究の質の向上が図られる
・ 臨床研究に参加を希望する患者が、質の高い臨床研究を行う病院を把握した上で当該病院へアクセスできるようになる
・ 患者を集約し、十分な管理体制の下で診療データの収集等を行うことで、臨床研究が集約的かつ効率的に行われるようにな
る
ことにより、質の高い臨床研究を推進し、次世代のより良質な医療の提供を可能にすることを目的としている。
○ 臨床研究中核病院には、医療技術実用化総合促進事業と臨床研究総合促進事業において、令和6年度は、
合計:約31億円(1医療機関あたり約2億円)を補助している。
○ 一定の組織体制・能力に係る基準を満たした病院について、厚生労働大臣が社会保障審議会の意見を聴いた上で、臨
床研究中核病院として承認する。令和6年9月現在、下記の15病院が承認されている。
・国立がん研究センター中央病院
・京都大学医学部附属病院
・東北大学病院
・千葉大学医学部附属病院
・順天堂大学医学部附属順天堂医院
・名古屋大学医学部附属病院
・北海道大学病院
・東京大学医学部附属病院
・九州大学病院
・神戸大学医学部附属病院
・国立がん研究センター東病院
・大阪大学医学部附属病院
・岡山大学病院
・慶應義塾大学病院
・長崎大学病院
2