よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件見直しについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
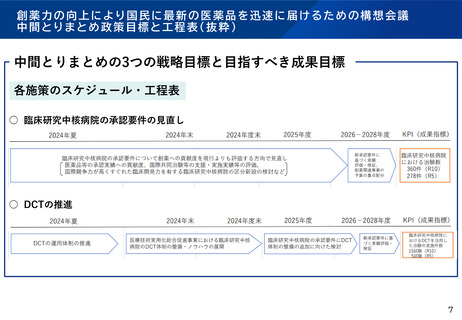
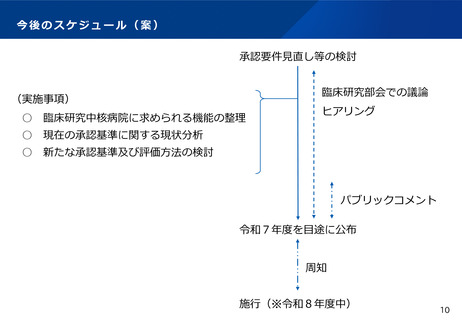
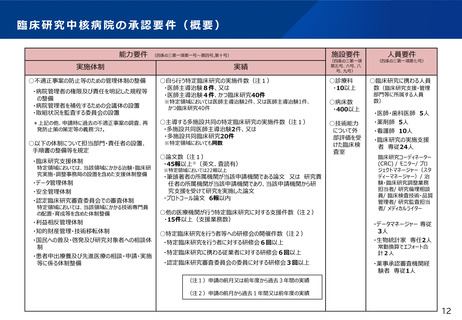
臨床研究中核病院の承認要件に関する今後の進め方(案)
臨床研究中核病院の承認要件について、下記の観点で、改めて整理してはどうか。
○ 「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」
等の指摘や、最近の臨床研究・治験を取り巻く環境の変化などを踏まえて、
臨床研究中核病院の機能や役割について、どう考えるか。
例えば、
• 国際共同治験の実績
• 創薬への貢献度の評価方法の導入
• 臨床研究中核病院で実施される医師主導治験や臨床研究の実績に関し
て、研究内容を踏まえた評価方法の導入
※第35回厚生科学審議会臨床研究部会において議論された
「承認要件未達時の取扱い」についても併せて議論する
9
臨床研究中核病院の承認要件について、下記の観点で、改めて整理してはどうか。
○ 「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」
等の指摘や、最近の臨床研究・治験を取り巻く環境の変化などを踏まえて、
臨床研究中核病院の機能や役割について、どう考えるか。
例えば、
• 国際共同治験の実績
• 創薬への貢献度の評価方法の導入
• 臨床研究中核病院で実施される医師主導治験や臨床研究の実績に関し
て、研究内容を踏まえた評価方法の導入
※第35回厚生科学審議会臨床研究部会において議論された
「承認要件未達時の取扱い」についても併せて議論する
9