よむ、つかう、まなぶ。
議題3 別紙4 先進医療の保険導入等の検討について (5 ページ)
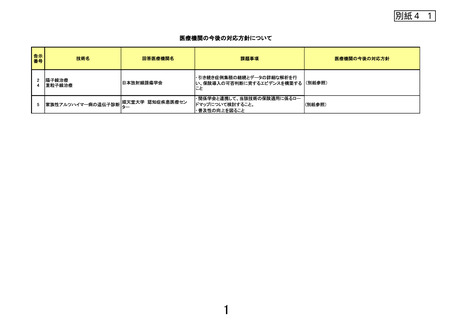
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44034.html |
| 出典情報 | 先進医療会議(第136回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
次期診療報酬改訂にむけた適応症ごとの報告事項について以下に示します.
1.食道癌
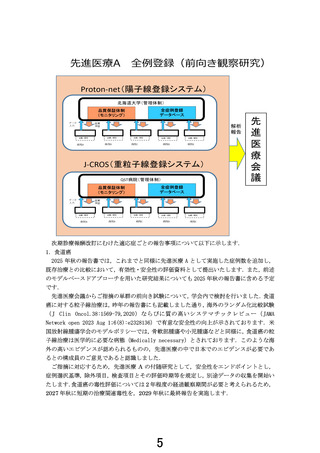
2025 年秋の報告書では,これまでと同様に先進医療 A として実施した症例数を追加し,
既存治療との比較において,有効性・安全性の評価資料として提出いたします.また,前述
のモデルベースドアプローチを用いた研究結果についても 2025 年秋の報告書に含める予定
です.
先進医療会議からご指摘の単群の前向き試験について,学会内で検討を行いました.食道
癌に対する粒子線治療は,昨年の報告書にも記載しました通り,海外のランダム化比較試験
(J Clin Oncol.38:1569-79,2020)ならびに質の高いシステマチックレビュー(JAMA
Network open 2023 Aug 1;6(8):e2328136)で有意な安全性の向上が示されております.米
国放射線腫瘍学会のモデルポリシーでは,骨軟部腫瘍や小児腫瘍などと同様に,食道癌の粒
子線治療は医学的に必要な病態(Medically necessary)とされております.このような海
外の高いエビデンスが認められるものの,先進医療の中で日本でのエビデンスが必要であ
るとの構成員のご意見であると認識しました.
ご指摘に対応するため,先進医療 A の付随研究として,安全性をエンドポイントとし,
症例選択基準,除外項目,検査項目とその評価時期等を規定し,別途データの収集を開始い
たします.
食道癌の毒性評価については 2 年程度の経過観察期間が必要と考えられるため,
2027 年秋に短期の治療関連毒性を,2029 年秋に最終報告を実施します.
5
1.食道癌
2025 年秋の報告書では,これまでと同様に先進医療 A として実施した症例数を追加し,
既存治療との比較において,有効性・安全性の評価資料として提出いたします.また,前述
のモデルベースドアプローチを用いた研究結果についても 2025 年秋の報告書に含める予定
です.
先進医療会議からご指摘の単群の前向き試験について,学会内で検討を行いました.食道
癌に対する粒子線治療は,昨年の報告書にも記載しました通り,海外のランダム化比較試験
(J Clin Oncol.38:1569-79,2020)ならびに質の高いシステマチックレビュー(JAMA
Network open 2023 Aug 1;6(8):e2328136)で有意な安全性の向上が示されております.米
国放射線腫瘍学会のモデルポリシーでは,骨軟部腫瘍や小児腫瘍などと同様に,食道癌の粒
子線治療は医学的に必要な病態(Medically necessary)とされております.このような海
外の高いエビデンスが認められるものの,先進医療の中で日本でのエビデンスが必要であ
るとの構成員のご意見であると認識しました.
ご指摘に対応するため,先進医療 A の付随研究として,安全性をエンドポイントとし,
症例選択基準,除外項目,検査項目とその評価時期等を規定し,別途データの収集を開始い
たします.
食道癌の毒性評価については 2 年程度の経過観察期間が必要と考えられるため,
2027 年秋に短期の治療関連毒性を,2029 年秋に最終報告を実施します.
5