よむ、つかう、まなぶ。
総-2令和7年度薬価改定について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48696.html |
| 出典情報 | 中央社会保険医療協議会 総会(第602回 1/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
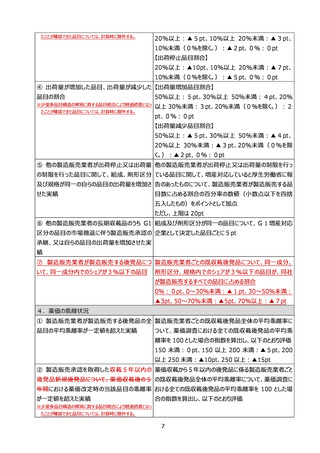
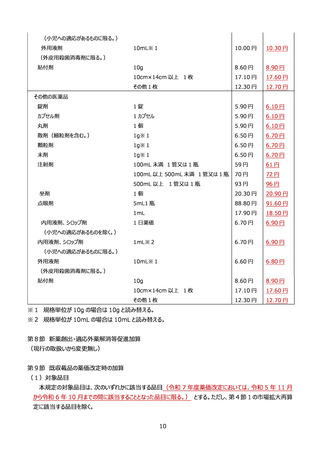
7年度薬価改定を除く。)の時点における年間販売額(同一組成既収載品群の年間販売額をいう。)か
ら 10 倍以上となった場合に、別表8に定める算式により算定される額に改定する。
(略)
(4)薬価改定時の加算等の取扱い
《骨子》
令和 7 年度薬価改定においては、令和 5 年 11 月から令和 6 年 10 月までの間に小児又は希
少疾病に係る効能又は効果が追加された品目等に限り、薬価改定時の加算の適用対象であるもの
又は新薬創出等加算の要件に該当するものとする。
【改正後】
第9節 既収載品の薬価改定時の加算
(1)対象品目
本規定の対象品目は、次のいずれかに該当する品目(令和 7 年度薬価改定においては、令和 5 年 11
月から令和 6 年 10 月までの間に該当することとなった品目に限る。)とする。ただし、第4節1の市場拡大
再算定に該当する品目を除く。
※上記のほか、以下の記載整備を行う。
第2章 新規収載品の薬価算定
第2部 新規後発品の薬価算定
1 新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬がない場合
イ (略)
ロ バイオ後続品等に係る特例
当該新規収載品が先発品と組成及び剤形区分が同一のバイオ医薬品又はバイオ後続品である場合には、
新薬として薬価収載された既収載品中の当該新規後発品の最類似薬を比較薬として、類似薬効比較方式
(Ⅰ)によって算定される額(共同開発その他の理由により、組成及び剤形区分が同一の最類似薬が複数と
なる場合には、それぞれについて類似薬効比較方式(Ⅰ)によって算定される額を当該最類似薬の年間販売
量で加重平均した額)に 100 分の 70 を乗じて得た額(ただし、内用薬については、当該新規後発品及び同
時期の薬価収載が予定される組成、剤形区分及び規格が当該新規後発品と同一の後発品(効能又は効果
が当該新規後発品と類似しているものに限る。)の銘柄数が 10 を超える場合は、100 分の 60 を乗じて得た
額)に、当該バイオ後続品の製造販売業者が承認を申請するに当たって患者を対象に実施した臨床試験の充
実度に応じて、100 分の 10 を上限とする割合を当該額に乗じて得た額を加えた額を当該新規後発品の薬価と
する。
ただし、当該新規収載品が、先発品と組成及び剤形区分が同一のバイオ医薬品(バイオ後続品を除く。)
である後発品の場合は、臨床試験の充実度に応じた加算は行わないものとする。
ハ~ヘ (略)
2 新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬がある場合
(1) 新規後発品として薬価収載された既収載品中に、組成、剤形区分及び規格が新規後発品と同一の
類似薬がある場合
15
ら 10 倍以上となった場合に、別表8に定める算式により算定される額に改定する。
(略)
(4)薬価改定時の加算等の取扱い
《骨子》
令和 7 年度薬価改定においては、令和 5 年 11 月から令和 6 年 10 月までの間に小児又は希
少疾病に係る効能又は効果が追加された品目等に限り、薬価改定時の加算の適用対象であるもの
又は新薬創出等加算の要件に該当するものとする。
【改正後】
第9節 既収載品の薬価改定時の加算
(1)対象品目
本規定の対象品目は、次のいずれかに該当する品目(令和 7 年度薬価改定においては、令和 5 年 11
月から令和 6 年 10 月までの間に該当することとなった品目に限る。)とする。ただし、第4節1の市場拡大
再算定に該当する品目を除く。
※上記のほか、以下の記載整備を行う。
第2章 新規収載品の薬価算定
第2部 新規後発品の薬価算定
1 新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬がない場合
イ (略)
ロ バイオ後続品等に係る特例
当該新規収載品が先発品と組成及び剤形区分が同一のバイオ医薬品又はバイオ後続品である場合には、
新薬として薬価収載された既収載品中の当該新規後発品の最類似薬を比較薬として、類似薬効比較方式
(Ⅰ)によって算定される額(共同開発その他の理由により、組成及び剤形区分が同一の最類似薬が複数と
なる場合には、それぞれについて類似薬効比較方式(Ⅰ)によって算定される額を当該最類似薬の年間販売
量で加重平均した額)に 100 分の 70 を乗じて得た額(ただし、内用薬については、当該新規後発品及び同
時期の薬価収載が予定される組成、剤形区分及び規格が当該新規後発品と同一の後発品(効能又は効果
が当該新規後発品と類似しているものに限る。)の銘柄数が 10 を超える場合は、100 分の 60 を乗じて得た
額)に、当該バイオ後続品の製造販売業者が承認を申請するに当たって患者を対象に実施した臨床試験の充
実度に応じて、100 分の 10 を上限とする割合を当該額に乗じて得た額を加えた額を当該新規後発品の薬価と
する。
ただし、当該新規収載品が、先発品と組成及び剤形区分が同一のバイオ医薬品(バイオ後続品を除く。)
である後発品の場合は、臨床試験の充実度に応じた加算は行わないものとする。
ハ~ヘ (略)
2 新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬がある場合
(1) 新規後発品として薬価収載された既収載品中に、組成、剤形区分及び規格が新規後発品と同一の
類似薬がある場合
15