よむ、つかう、まなぶ。
【先進医療会議】議題1 別紙2新規技術(2月受理分)の先進医療A又は先進医療Bへの振り分けについて(案) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_50847.html |
| 出典情報 | 先進医療合同会議(第140回先進医療会議、第171回先進医療技術審査部会 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
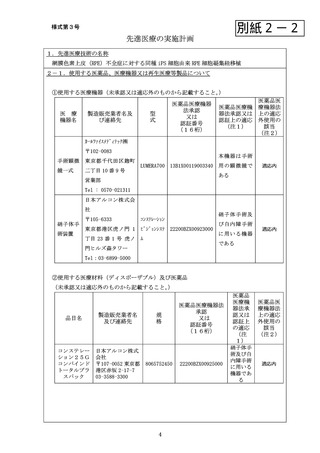
③使用する再生医療等製品(未承認又は適応外のものから記載すること。
)
医薬品医療
医薬品医療
医薬品医療機
製造販売業
機器法承認
機器法上の
規
器法承認又は
品目名
者名及び連
又は
適応外使用
格
認証上の適応
絡先
認証番号
の該当
(注1)
(16桁)
(注2)
ヒト(同 1)外観検査、 ‐
‐
未承認
種)iPS 細
2)生細胞率、
胞 由 来
3)無菌、
RPE 細 胞
4)マイコプラ
凝集紐
ズマ、
5)エンドトキ
シン
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に該
当する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
医薬品医療機器法承認一部変更申請状況
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適応
外使用に該当する場合の使用方法等
手術室にて硝子体手術による網膜下挿入術により移植を行う。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適
応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
未承認
欧州での薬事承認の状況
未承認
5
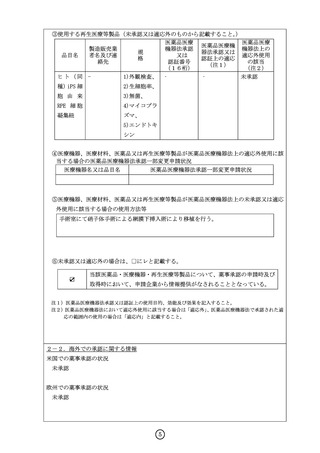
)
医薬品医療
医薬品医療
医薬品医療機
製造販売業
機器法承認
機器法上の
規
器法承認又は
品目名
者名及び連
又は
適応外使用
格
認証上の適応
絡先
認証番号
の該当
(注1)
(16桁)
(注2)
ヒト(同 1)外観検査、 ‐
‐
未承認
種)iPS 細
2)生細胞率、
胞 由 来
3)無菌、
RPE 細 胞
4)マイコプラ
凝集紐
ズマ、
5)エンドトキ
シン
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に該
当する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
医薬品医療機器法承認一部変更申請状況
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適応
外使用に該当する場合の使用方法等
手術室にて硝子体手術による網膜下挿入術により移植を行う。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適
応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
未承認
欧州での薬事承認の状況
未承認
5