よむ、つかう、まなぶ。
総-6参考3[797KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
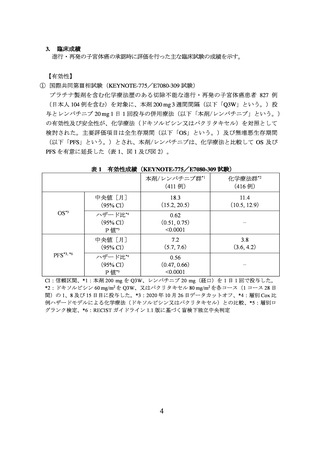
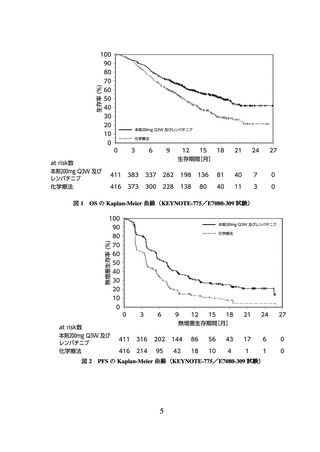
減少性紫斑病、溶血性貧血、赤芽球癆、無顆粒球症等)、血球貪食症候群及び結核は認
められなかった。本副作用発現状況は関連事象(臨床検査値異常を含む)を含む集計結
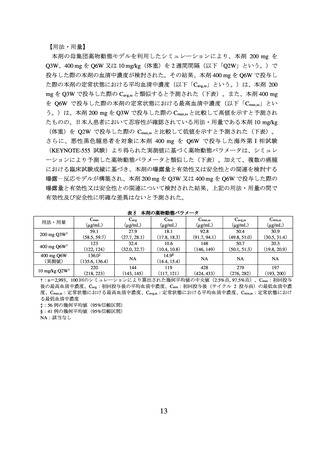
果を示す。
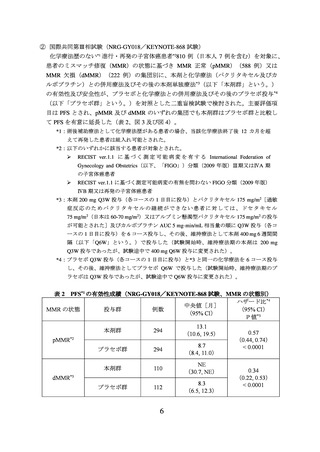
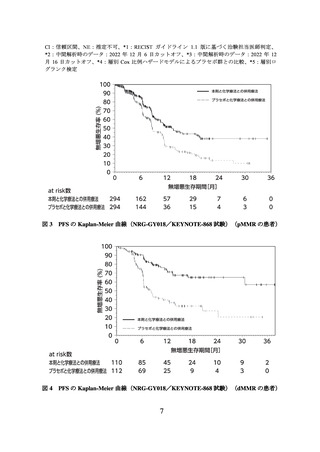
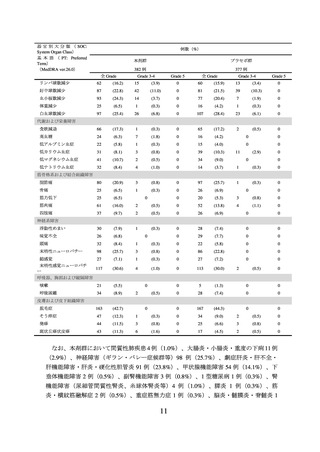
② 国際共同第Ⅲ相試験(NRG-GY018/KEYNOTE-868 試験)
有害事象は本剤群 376/382 例(98.4%)、プラセボ群 375/377 例(99.5%)に認められ、
治験薬との因果関係が否定できない有害事象は、それぞれ 365/382 例(95.5%)及び
358/377 例(95.0%)に認められた。いずれかの群で発現割合が 5%以上の副作用は下表
のとおりであった。
有害事象、副作用、安全性検討事項の発現割合は pMMR 及び dMMR の両集団を合算
して算出した。
表 4 いずれかの群で発現割合が 5%以上の副作用(NRG-GY018/KEYNOTE-868 試験)(安全性解析対象集団)
器 官 別 大 分 類 ( SOC:
System Organ Class)
基 本 語 ( PT: Preferred
Term)
(MedDRA ver.26.0)
例数(%)
本剤群
382 例
全 Grade
全副作用
プラセボ群
377 例
Grade 3-4
全 Grade
Grade 5
365
(95.5)
171
(44.8)
貧血
178
(46.6)
53
(13.9)
好中球減少症
20
(5.2)
12
(3.1)
甲状腺機能亢進症
23
(6.0)
甲状腺機能低下症
41
(10.7)
便秘
112
(29.3)
2
下痢
110
(28.8)
悪心
146
(38.2)
口内炎
31
嘔吐
48
225
1
(0.3)
Grade 3-4
Grade 5
358
(95.0)
120
(31.8)
2
(0.5)
0
162
(43.0)
29
(7.7)
0
0
19
(5.0)
8
(2.1)
0
0
0
9
(2.4)
0
0
0
0
11
(2.9)
0
0
(0.5)
0
90
(23.9)
1
(0.3)
0
5
(1.3)
0
103
(27.3)
4
(1.1)
0
4
(1.0)
0
129
(34.2)
4
(1.1)
0
(8.1)
2
(0.5)
0
15
(4.0)
(12.6)
2
(0.5)
0
37
(9.8)
4
(1.1)
0
(58.9)
5
(1.3)
0
197
(52.3)
7
(1.9)
0
19
(5.0)
7
(1.8)
0
3
(0.8)
42
(11.0)
3
(0.8)
0
43
(11.4)
5
(1.3)
0
42
(11.0)
3
(0.8)
0
31
(8.2)
2
(0.5)
0
40
(10.5)
6
(1.6)
0
18
(4.8)
35
(9.2)
1
(0.3)
0
33
(8.8)
39
(10.2)
2
(0.5)
0
12
(3.2)
血液およびリンパ系障害
内分泌障害
胃腸障害
0
0
一般・全身障害および投与部位の状態
疲労
感染症および寄生虫症
尿路感染
0
0
傷害、中毒および処置合併症
注入に伴う反応
臨床検査
アラニンアミノトランス
フェラーゼ増加
アスパラギン酸アミノト
ランスフェラーゼ増加
血中アルカリホスファタ
ーゼ増加
血中クレアチニン増加
10
0
1
0
(0.3)
0
0
0
められなかった。本副作用発現状況は関連事象(臨床検査値異常を含む)を含む集計結
果を示す。
② 国際共同第Ⅲ相試験(NRG-GY018/KEYNOTE-868 試験)
有害事象は本剤群 376/382 例(98.4%)、プラセボ群 375/377 例(99.5%)に認められ、
治験薬との因果関係が否定できない有害事象は、それぞれ 365/382 例(95.5%)及び
358/377 例(95.0%)に認められた。いずれかの群で発現割合が 5%以上の副作用は下表
のとおりであった。
有害事象、副作用、安全性検討事項の発現割合は pMMR 及び dMMR の両集団を合算
して算出した。
表 4 いずれかの群で発現割合が 5%以上の副作用(NRG-GY018/KEYNOTE-868 試験)(安全性解析対象集団)
器 官 別 大 分 類 ( SOC:
System Organ Class)
基 本 語 ( PT: Preferred
Term)
(MedDRA ver.26.0)
例数(%)
本剤群
382 例
全 Grade
全副作用
プラセボ群
377 例
Grade 3-4
全 Grade
Grade 5
365
(95.5)
171
(44.8)
貧血
178
(46.6)
53
(13.9)
好中球減少症
20
(5.2)
12
(3.1)
甲状腺機能亢進症
23
(6.0)
甲状腺機能低下症
41
(10.7)
便秘
112
(29.3)
2
下痢
110
(28.8)
悪心
146
(38.2)
口内炎
31
嘔吐
48
225
1
(0.3)
Grade 3-4
Grade 5
358
(95.0)
120
(31.8)
2
(0.5)
0
162
(43.0)
29
(7.7)
0
0
19
(5.0)
8
(2.1)
0
0
0
9
(2.4)
0
0
0
0
11
(2.9)
0
0
(0.5)
0
90
(23.9)
1
(0.3)
0
5
(1.3)
0
103
(27.3)
4
(1.1)
0
4
(1.0)
0
129
(34.2)
4
(1.1)
0
(8.1)
2
(0.5)
0
15
(4.0)
(12.6)
2
(0.5)
0
37
(9.8)
4
(1.1)
0
(58.9)
5
(1.3)
0
197
(52.3)
7
(1.9)
0
19
(5.0)
7
(1.8)
0
3
(0.8)
42
(11.0)
3
(0.8)
0
43
(11.4)
5
(1.3)
0
42
(11.0)
3
(0.8)
0
31
(8.2)
2
(0.5)
0
40
(10.5)
6
(1.6)
0
18
(4.8)
35
(9.2)
1
(0.3)
0
33
(8.8)
39
(10.2)
2
(0.5)
0
12
(3.2)
血液およびリンパ系障害
内分泌障害
胃腸障害
0
0
一般・全身障害および投与部位の状態
疲労
感染症および寄生虫症
尿路感染
0
0
傷害、中毒および処置合併症
注入に伴う反応
臨床検査
アラニンアミノトランス
フェラーゼ増加
アスパラギン酸アミノト
ランスフェラーゼ増加
血中アルカリホスファタ
ーゼ増加
血中クレアチニン増加
10
0
1
0
(0.3)
0
0
0