よむ、つかう、まなぶ。
総-6参考3[797KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
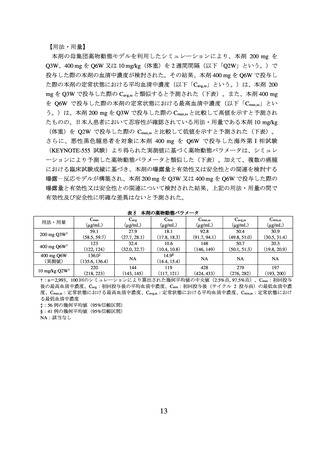
② 国際共同第Ⅲ相試験(NRG-GY018/KEYNOTE-868 試験)
化学療法歴のない*1 進行・再発の子宮体癌患者*2810 例(日本人 7 例を含む)を対象に、
患者のミスマッチ修復(MMR)の状態に基づき MMR 正常(pMMR)(588 例)又は
MMR 欠損(dMMR)(222 例)の集団別に、本剤と化学療法(パクリタキセル及びカ
ルボプラチン)との併用療法及びその後の本剤単独療法*3(以下「本剤群」という。)
の有効性及び安全性が、プラセボと化学療法との併用療法及びその後のプラセボ投与*4
(以下「プラセボ群」という。)を対照とした二重盲検試験で検討された。主要評価項
目は PFS とされ、pMMR 及び dMMR のいずれの集団でも本剤群はプラセボ群と比較し
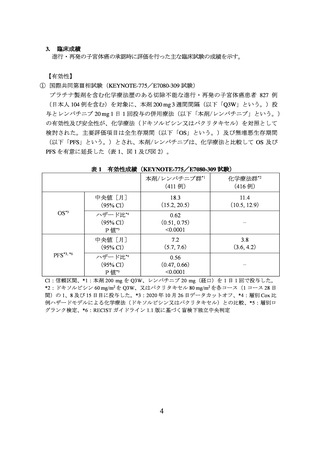
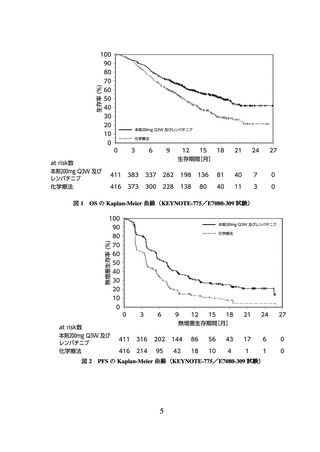
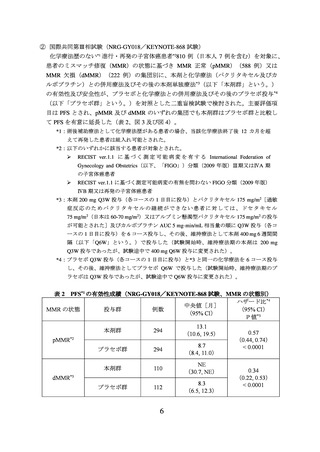
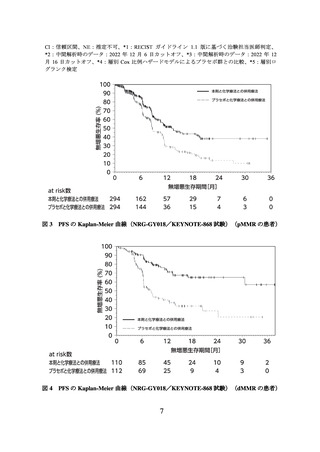
て PFS を有意に延長した(表 2、図 3 及び図 4)。
*1:術後補助療法として化学療法歴がある患者の場合、当該化学療法終了後 12 カ月を超
えて再発した患者は組入れ可能とされた。
*2:以下のいずれかに該当する患者が対象とされた。
➢
RECIST ver.1.1 に 基 づ く 測 定 可 能 病 変 を 有 す る International Federation of
Gynecology and Obstetrics(以下、「FIGO」)分類(2009 年版)Ⅲ期又はⅣA 期
の子宮体癌患者
➢
RECIST ver.1.1 に基づく測定可能病変の有無を問わない FIGO 分類(2009 年版)
ⅣB 期又は再発の子宮体癌患者
*3:本剤 200 mg Q3W 投与(各コースの 1 日目に投与)とパクリタキセル 175 mg/m2[過敏
症反応のためパクリタキセルの継続ができない患者に対しては、ドセタキセル
75 mg/m2(日本は 60-70 mg/m2)又はアルブミン懸濁型パクリタキセル 175 mg/m2 の投与
が可能とされた]及びカルボプラチン AUC 5 mg·min/mL 相当量の順に Q3W 投与(各コ
ースの 1 日目に投与)を 6 コース投与し、その後、維持療法として本剤 400 mg 6 週間間
隔(以下「Q6W」という。)で投与した(試験開始時、維持療法期の本剤は 200 mg
Q3W 投与であったが、試験途中で 400 mg Q6W 投与に変更された)。
*4:プラセボ Q3W 投与(各コースの 1 日目に投与)と*3 と同一の化学療法を 6 コース投与
し、その後、維持療法としてプラセボ Q6W で投与した(試験開始時、維持療法期のプ
ラセボは Q3W 投与であったが、試験途中で Q6W 投与に変更された)。
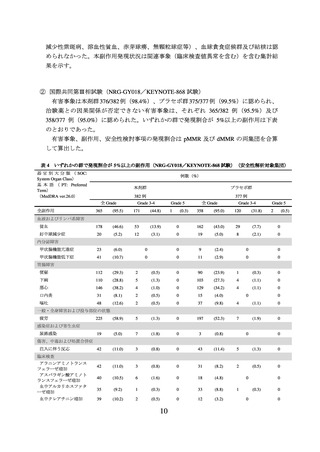
表2
PFS*1 の有効性成績(NRG-GY018/KEYNOTE-868 試験、MMR の状態別)
ハザード比*4
中央値[月]
MMR の状態
投与群
例数
(95% CI)
(95% CI)
P 値*5
本剤群
294
13.1
(10.6, 19.5)
プラセボ群
294
8.7
(8.4, 11.0)
本剤群
110
NE
(30.7, NE)
プラセボ群
112
8.3
(6.5, 12.3)
*2
pMMR
dMMR*3
6
0.57
(0.44, 0.74)
< 0.0001
0.34
(0.22, 0.53)
< 0.0001
化学療法歴のない*1 進行・再発の子宮体癌患者*2810 例(日本人 7 例を含む)を対象に、
患者のミスマッチ修復(MMR)の状態に基づき MMR 正常(pMMR)(588 例)又は
MMR 欠損(dMMR)(222 例)の集団別に、本剤と化学療法(パクリタキセル及びカ
ルボプラチン)との併用療法及びその後の本剤単独療法*3(以下「本剤群」という。)
の有効性及び安全性が、プラセボと化学療法との併用療法及びその後のプラセボ投与*4
(以下「プラセボ群」という。)を対照とした二重盲検試験で検討された。主要評価項
目は PFS とされ、pMMR 及び dMMR のいずれの集団でも本剤群はプラセボ群と比較し
て PFS を有意に延長した(表 2、図 3 及び図 4)。
*1:術後補助療法として化学療法歴がある患者の場合、当該化学療法終了後 12 カ月を超
えて再発した患者は組入れ可能とされた。
*2:以下のいずれかに該当する患者が対象とされた。
➢
RECIST ver.1.1 に 基 づ く 測 定 可 能 病 変 を 有 す る International Federation of
Gynecology and Obstetrics(以下、「FIGO」)分類(2009 年版)Ⅲ期又はⅣA 期
の子宮体癌患者
➢
RECIST ver.1.1 に基づく測定可能病変の有無を問わない FIGO 分類(2009 年版)
ⅣB 期又は再発の子宮体癌患者
*3:本剤 200 mg Q3W 投与(各コースの 1 日目に投与)とパクリタキセル 175 mg/m2[過敏
症反応のためパクリタキセルの継続ができない患者に対しては、ドセタキセル
75 mg/m2(日本は 60-70 mg/m2)又はアルブミン懸濁型パクリタキセル 175 mg/m2 の投与
が可能とされた]及びカルボプラチン AUC 5 mg·min/mL 相当量の順に Q3W 投与(各コ
ースの 1 日目に投与)を 6 コース投与し、その後、維持療法として本剤 400 mg 6 週間間
隔(以下「Q6W」という。)で投与した(試験開始時、維持療法期の本剤は 200 mg
Q3W 投与であったが、試験途中で 400 mg Q6W 投与に変更された)。
*4:プラセボ Q3W 投与(各コースの 1 日目に投与)と*3 と同一の化学療法を 6 コース投与
し、その後、維持療法としてプラセボ Q6W で投与した(試験開始時、維持療法期のプ
ラセボは Q3W 投与であったが、試験途中で Q6W 投与に変更された)。
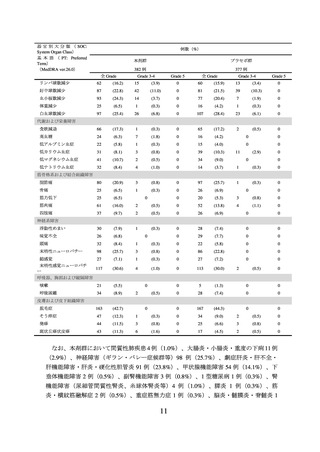
表2
PFS*1 の有効性成績(NRG-GY018/KEYNOTE-868 試験、MMR の状態別)
ハザード比*4
中央値[月]
MMR の状態
投与群
例数
(95% CI)
(95% CI)
P 値*5
本剤群
294
13.1
(10.6, 19.5)
プラセボ群
294
8.7
(8.4, 11.0)
本剤群
110
NE
(30.7, NE)
プラセボ群
112
8.3
(6.5, 12.3)
*2
pMMR
dMMR*3
6
0.57
(0.44, 0.74)
< 0.0001
0.34
(0.22, 0.53)
< 0.0001