よむ、つかう、まなぶ。
参考資料 18 コスタイベ筋注用 市販直後調査 第6回結果報告[935KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
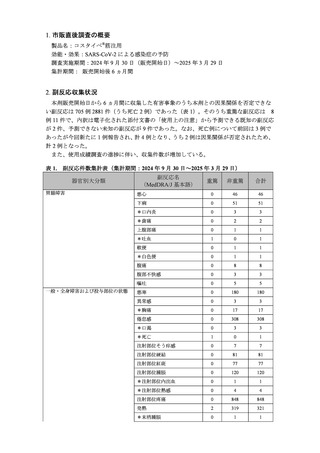
1. 市販直後調査の概要
製品名:コスタイベ®筋注用
効能・効果:SARS-CoV-2 による感染症の予防
調査実施期間:2024 年 9 月 30 日(販売開始日)~2025 年 3 月 29 日
集計期間: 販売開始後 6 ヵ月間
2. 副反応収集状況
本剤販売開始日から 6 ヵ月間に収集した有害事象のうち本剤との因果関係を否定できな
い副反応は 705 例 2881 件(うち死亡 2 例)であった(表 1)。そのうち重篤な副反応は
8
例 11 件で、内訳は電子化された添付文書の「使用上の注意」から予測できる既知の副反応
が 2 件、予測できない未知の副反応が 9 件であった。なお、死亡例について前回は 3 例で
あったが今回新たに 1 例報告され、計 4 例となり、うち 2 例は因果関係が否定されたため、
計 2 例となった。
また、使用成績調査の進捗に伴い、収集件数が増加している。
表 1.
副反応件数集計表(集計期間:2024 年 9 月 30 日~2025 年 3 月 29 日)
器官別大分類
胃腸障害
一般・全身障害および投与部位の状態
副反応名
(MedDRA/J 基本語)
重篤
非重篤
合計
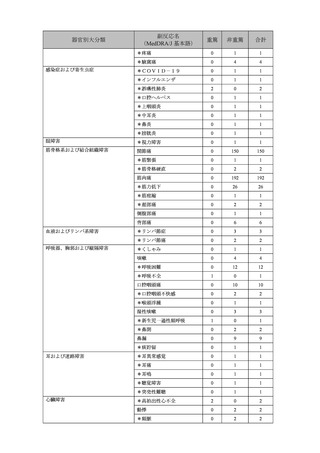
悪心
0
46
46
下痢
0
51
51
*口内炎
0
3
3
*歯痛
0
2
2
上腹部痛
0
1
1
*吐血
1
0
1
軟便
0
1
1
*白色便
0
1
1
腹痛
0
8
8
腹部不快感
0
3
3
嘔吐
0
5
5
悪寒
0
180
180
異常感
0
3
3
*胸痛
0
17
17
倦怠感
0
308
308
*口渇
0
3
3
*死亡
1
0
1
注射部位そう痒感
0
7
7
注射部位硬結
0
81
81
注射部位紅斑
0
77
77
注射部位腫脹
0
120
120
*注射部位内出血
0
1
1
*注射部位熱感
0
4
4
注射部位疼痛
0
848
848
発熱
2
319
321
*末梢腫脹
0
1
1
製品名:コスタイベ®筋注用
効能・効果:SARS-CoV-2 による感染症の予防
調査実施期間:2024 年 9 月 30 日(販売開始日)~2025 年 3 月 29 日
集計期間: 販売開始後 6 ヵ月間
2. 副反応収集状況
本剤販売開始日から 6 ヵ月間に収集した有害事象のうち本剤との因果関係を否定できな
い副反応は 705 例 2881 件(うち死亡 2 例)であった(表 1)。そのうち重篤な副反応は
8
例 11 件で、内訳は電子化された添付文書の「使用上の注意」から予測できる既知の副反応
が 2 件、予測できない未知の副反応が 9 件であった。なお、死亡例について前回は 3 例で
あったが今回新たに 1 例報告され、計 4 例となり、うち 2 例は因果関係が否定されたため、
計 2 例となった。
また、使用成績調査の進捗に伴い、収集件数が増加している。
表 1.
副反応件数集計表(集計期間:2024 年 9 月 30 日~2025 年 3 月 29 日)
器官別大分類
胃腸障害
一般・全身障害および投与部位の状態
副反応名
(MedDRA/J 基本語)
重篤
非重篤
合計
悪心
0
46
46
下痢
0
51
51
*口内炎
0
3
3
*歯痛
0
2
2
上腹部痛
0
1
1
*吐血
1
0
1
軟便
0
1
1
*白色便
0
1
1
腹痛
0
8
8
腹部不快感
0
3
3
嘔吐
0
5
5
悪寒
0
180
180
異常感
0
3
3
*胸痛
0
17
17
倦怠感
0
308
308
*口渇
0
3
3
*死亡
1
0
1
注射部位そう痒感
0
7
7
注射部位硬結
0
81
81
注射部位紅斑
0
77
77
注射部位腫脹
0
120
120
*注射部位内出血
0
1
1
*注射部位熱感
0
4
4
注射部位疼痛
0
848
848
発熱
2
319
321
*末梢腫脹
0
1
1