よむ、つかう、まなぶ。
資料5-3 企業から提出された開発工程表の概要等(第I回要望) (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00023.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第51回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
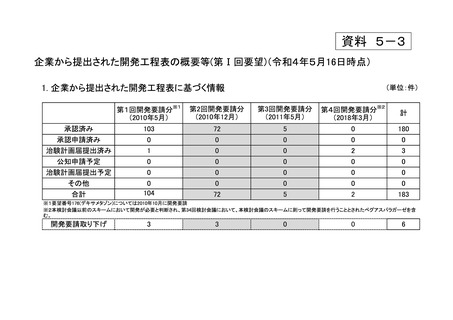
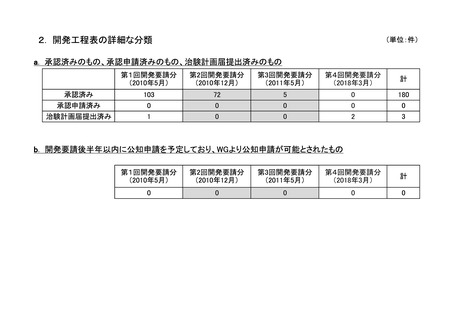
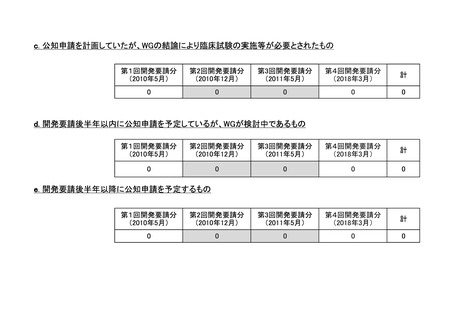
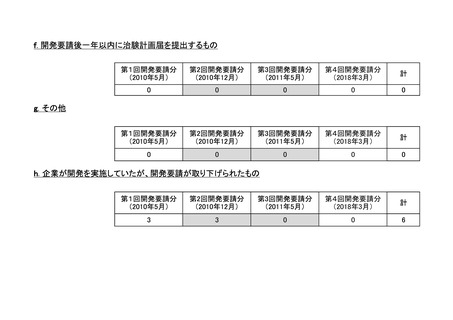
要望番
号
企業名
成分名
販売名
承認内容
承認済み(承認月)
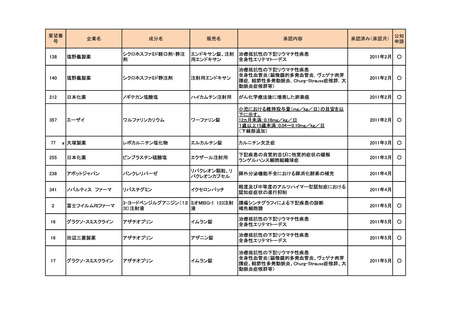
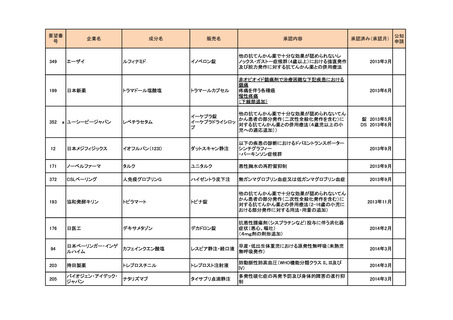
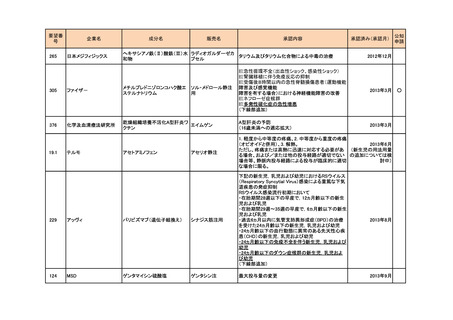
374
サノフィ
4価髄膜炎菌ワクチン(ジフテリ
メナクトラ筋注
アトキソイド結合体)
髄膜炎菌(血清型A、C、Y及びW-135)による侵襲
性髄膜炎菌感染症の予防
2014年7月
142
マイラン製薬
システアミン酒石酸塩
腎性シスチン症
2014年7月
289
ファイザ-
ボリコナゾール
ニシスタゴンカプセル
<小児用法・用量の追加>
**小児(2歳以上12歳未満及び12歳以上で体重50kg
未満)
ボリコナゾール注射剤による治療を行った後、通常、
ボリコナゾールとして1回9mg/kgを1日2回食間に経口
投与する。なお、効果不十分の場合には1mg/kgずつ
増量し、忍容性が不十分の場合には1mg/kgずつ減
量する(最大投与量として350mgを用いた場合は
50mgずつ減量する)。
ブイフェンド静注用、ブ
ただし、1回350mg1日2回を上限とする。
イフェンド錠
2014年9月
**小児(12歳以上で体重50kg以上)
ボリコナゾール注射剤による治療を行った後、通常、
ボリコナゾールとして1回200mgを1日2回食間に経口
投与する。なお、効果不十分の場合には1回300mg1
日2回まで増量できる。
<剤形の追加>
ブイフェンドライシロップ2800mg
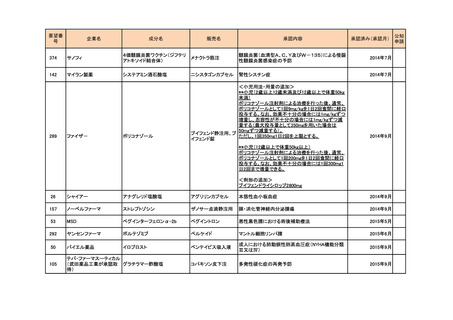
26
シャイアー
アナグレリド塩酸塩
アグリリンカプセル
本態性血小板血症
2014年9月
157
ノーベルファーマ
ストレプトゾシン
ザノサー点滴静注用
膵・消化管神経内分泌腫瘍
2014年9月
53
MSD
ペグインターフェロンα-2b
ペグイントロン
悪性黒色腫における術後補助療法
2015年5月
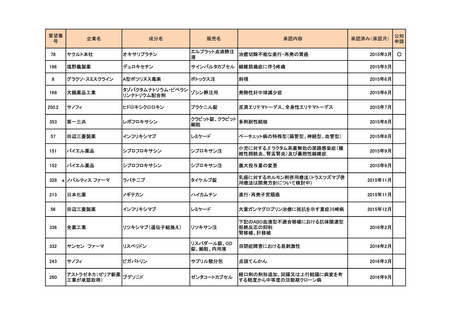
292
ヤンセンファーマ
ボルテゾミブ
ベルケイド
マントル細胞リンパ腫
2015年6月
50
バイエル薬品
イロプロスト
ベンテイビス吸入液
成人における肺動脈性肺高血圧症(NYHA機能分類
Ⅲ又はⅣ)
2015年9月
105
テバ・ファーマスーティカル
(武田薬品工業が承認取 グラチラマー酢酸塩
得)
コパキソン皮下注
多発性硬化症の再発予防
2015年9月
公知
申請
号
企業名
成分名
販売名
承認内容
承認済み(承認月)
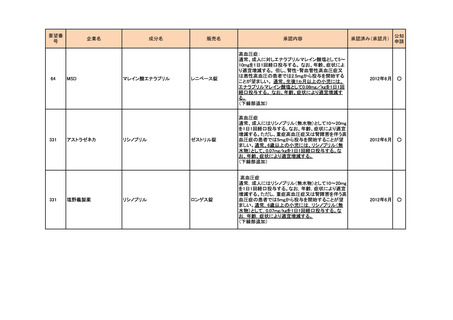
374
サノフィ
4価髄膜炎菌ワクチン(ジフテリ
メナクトラ筋注
アトキソイド結合体)
髄膜炎菌(血清型A、C、Y及びW-135)による侵襲
性髄膜炎菌感染症の予防
2014年7月
142
マイラン製薬
システアミン酒石酸塩
腎性シスチン症
2014年7月
289
ファイザ-
ボリコナゾール
ニシスタゴンカプセル
<小児用法・用量の追加>
**小児(2歳以上12歳未満及び12歳以上で体重50kg
未満)
ボリコナゾール注射剤による治療を行った後、通常、
ボリコナゾールとして1回9mg/kgを1日2回食間に経口
投与する。なお、効果不十分の場合には1mg/kgずつ
増量し、忍容性が不十分の場合には1mg/kgずつ減
量する(最大投与量として350mgを用いた場合は
50mgずつ減量する)。
ブイフェンド静注用、ブ
ただし、1回350mg1日2回を上限とする。
イフェンド錠
2014年9月
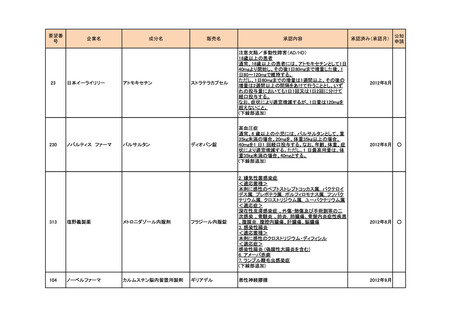
**小児(12歳以上で体重50kg以上)
ボリコナゾール注射剤による治療を行った後、通常、
ボリコナゾールとして1回200mgを1日2回食間に経口
投与する。なお、効果不十分の場合には1回300mg1
日2回まで増量できる。
<剤形の追加>
ブイフェンドライシロップ2800mg
26
シャイアー
アナグレリド塩酸塩
アグリリンカプセル
本態性血小板血症
2014年9月
157
ノーベルファーマ
ストレプトゾシン
ザノサー点滴静注用
膵・消化管神経内分泌腫瘍
2014年9月
53
MSD
ペグインターフェロンα-2b
ペグイントロン
悪性黒色腫における術後補助療法
2015年5月
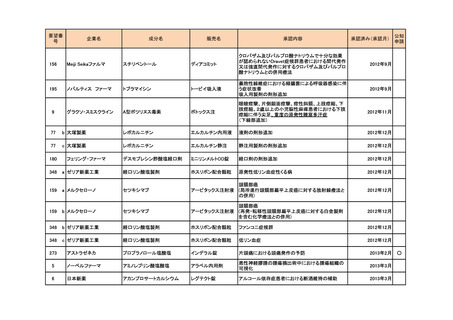
292
ヤンセンファーマ
ボルテゾミブ
ベルケイド
マントル細胞リンパ腫
2015年6月
50
バイエル薬品
イロプロスト
ベンテイビス吸入液
成人における肺動脈性肺高血圧症(NYHA機能分類
Ⅲ又はⅣ)
2015年9月
105
テバ・ファーマスーティカル
(武田薬品工業が承認取 グラチラマー酢酸塩
得)
コパキソン皮下注
多発性硬化症の再発予防
2015年9月
公知
申請