よむ、つかう、まなぶ。
別紙3 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00018.html |
| 出典情報 | 患者申出療養評価会議(第32回 6/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
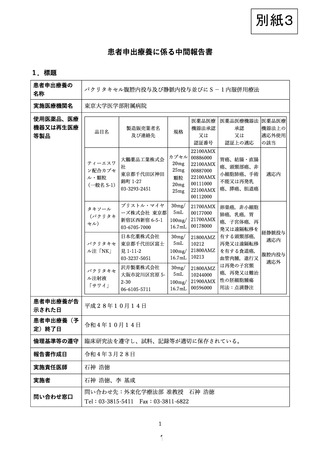
② 朝食後及び夕食後の1日2回経口投与を行う。
③ 14日間の投与とその後の7日間の休薬を1コースとして投与を行う。
④ 有害事象発現時の投与量の変更は、実施計画書「6.5.6.投与量の変更基準」に従う。
4.4. パクリタキセルの投与
① パクリタキセルの初回投与量は経静脈投与50mg/m2、腹腔内投与20mg/m2とする。た
だし、研究責任医師または分担医師が被験者の安全性確保のため必要と判断した場合
は、適宜減量して投与することも可能とする。
② 各コースの第1, 8日に投与基準を満たしていることを確認した後に投与する。
③ 過敏症状の発現を防止するため、前投薬(例:塩酸ジフェンヒドラミン、リン酸デキ
サメタゾンナトリウム、塩酸ラニチジンまたはファモチジン)を行う。
④ 以下の方法を参考にして投与を行う。
・ 前投薬を 30 分かけて行い、同時に腹腔ポートまたはカテーテルより生理食塩水 500ml
を 1 時間かけて腹腔内投与する。
・ 前投薬終了の 30 分後より 1 時間かけて、パクリタキセルを生理食塩水(または 5%
ブドウ糖注射液)100ml~250ml に溶解して静脈内に、生理食塩水 500ml に溶解して
腹腔内にインラインフィルターを通して投与する。
・ 腹水貯留例では、必要に応じて投与前に腹水をドレナージし、腹水量に応じて投与
する生理食塩水を減量する。
評価基準
[主要評価項目]
安全性評価基準
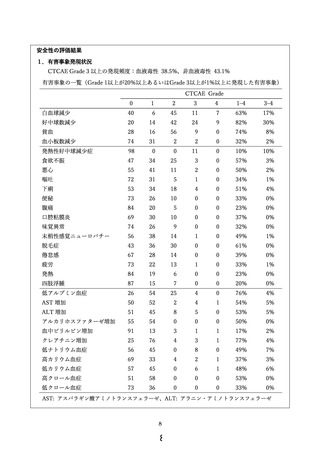
有害事象発現状況
研究責任(分担)医師がコースごとに有害事象の評価を行う。発現した症状は、NCI Common
Terminology Criteria for Adverse Events (CTCAE) v4.0(日本語訳 JCOG 版)に準じて判定する。
有害事象の調査は定期的な臨床検査、自他覚症状は診察時の問診、身体所見等により実施する。
[副次評価項目]
有効性評価基準
1.全生存期間
登録日を起算日として、あらゆる原因による死亡をイベントとする生存期間を全生存期間
と定義する。最終追跡調査時の生存者では、最終生存確認日をもって打ち切りとする。追跡
不能例では追跡不能となる以前で生存が確認された最終日をもって打ち切りとする。
2.奏効割合
抗腫瘍効果は Response Evaluation Criteria in Solid Tumors (RECIST) ver 1.1(日本語訳
JCOG 版)に従い評価する。標的病変を有する症例数を分母とし、最良総合効果が完全奏効
(CR) または部分奏効 (PR) である症例数を分子とする割合を奏効割合とする。抗腫瘍効果
評価症例で、治療開始後に腫瘍縮小効果を判定する検査が行われなかった症例のうち、明ら
かな原病悪化によるものは進行 (PD) 、それ以外は評価不能 (NE) として分母に加える。
5
5
③ 14日間の投与とその後の7日間の休薬を1コースとして投与を行う。
④ 有害事象発現時の投与量の変更は、実施計画書「6.5.6.投与量の変更基準」に従う。
4.4. パクリタキセルの投与
① パクリタキセルの初回投与量は経静脈投与50mg/m2、腹腔内投与20mg/m2とする。た
だし、研究責任医師または分担医師が被験者の安全性確保のため必要と判断した場合
は、適宜減量して投与することも可能とする。
② 各コースの第1, 8日に投与基準を満たしていることを確認した後に投与する。
③ 過敏症状の発現を防止するため、前投薬(例:塩酸ジフェンヒドラミン、リン酸デキ
サメタゾンナトリウム、塩酸ラニチジンまたはファモチジン)を行う。
④ 以下の方法を参考にして投与を行う。
・ 前投薬を 30 分かけて行い、同時に腹腔ポートまたはカテーテルより生理食塩水 500ml
を 1 時間かけて腹腔内投与する。
・ 前投薬終了の 30 分後より 1 時間かけて、パクリタキセルを生理食塩水(または 5%
ブドウ糖注射液)100ml~250ml に溶解して静脈内に、生理食塩水 500ml に溶解して
腹腔内にインラインフィルターを通して投与する。
・ 腹水貯留例では、必要に応じて投与前に腹水をドレナージし、腹水量に応じて投与
する生理食塩水を減量する。
評価基準
[主要評価項目]
安全性評価基準
有害事象発現状況
研究責任(分担)医師がコースごとに有害事象の評価を行う。発現した症状は、NCI Common
Terminology Criteria for Adverse Events (CTCAE) v4.0(日本語訳 JCOG 版)に準じて判定する。
有害事象の調査は定期的な臨床検査、自他覚症状は診察時の問診、身体所見等により実施する。
[副次評価項目]
有効性評価基準
1.全生存期間
登録日を起算日として、あらゆる原因による死亡をイベントとする生存期間を全生存期間
と定義する。最終追跡調査時の生存者では、最終生存確認日をもって打ち切りとする。追跡
不能例では追跡不能となる以前で生存が確認された最終日をもって打ち切りとする。
2.奏効割合
抗腫瘍効果は Response Evaluation Criteria in Solid Tumors (RECIST) ver 1.1(日本語訳
JCOG 版)に従い評価する。標的病変を有する症例数を分母とし、最良総合効果が完全奏効
(CR) または部分奏効 (PR) である症例数を分子とする割合を奏効割合とする。抗腫瘍効果
評価症例で、治療開始後に腫瘍縮小効果を判定する検査が行われなかった症例のうち、明ら
かな原病悪化によるものは進行 (PD) 、それ以外は評価不能 (NE) として分母に加える。
5
5