よむ、つかう、まなぶ。
試験の概要「ヌバキソビッド筋注」 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
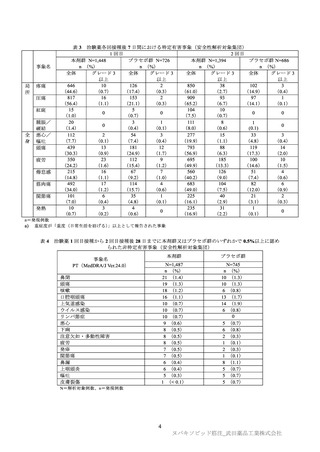
データカットオフ時点で、無作為化された 2,247 例のうち、治験を中止した 131 例を除く 2,116
例(1,414 例(94.8%)、702 例(92.9%))が治験継続中である。主な中止理由は同意撤回(53
例(3.6%)、39 例(5.2%))であった。また、141 例(89 例(6.0%)、52 例(6.9%))が盲検
解除され、盲検解除の主な理由は、既承認ワクチンの接種のため(60 例(4.0%)、40 例(5.3%))
であった。
データカットオフ時点で、PP-EFF 解析対象集団における 2 回目接種後 7 日以降の観察期間
(中央値)は、本剤群 64.0 日及びプラセボ群 63.0 日であった。各被験者の安全性については、
1 回目接種からクロスオーバー期間開始までのデータが評価され、安全性解析対象集団におけ
る 2 回目接種後の追跡調査期間(中央値)は本剤群、プラセボ群ともに 71 日であった。
有効性の主要評価項目とされた「ベースライン時に SARS-CoV-2 に対して血清学的陰性の被
験者における、PCR 検査で確定した症候性(軽症、中等症及び重症)の COVID-19 の最初の発
症」2)の結果は、PP-EFF 解析対象集団において表 1 のとおりであり、ワクチンの有効性3)(以
下「VE」という。)[両側 95%信頼区間]は 79.54[46.83, 92.13]%であった。認められた 20
例のイベントはすべて軽症であった。
表1
治験薬 2 回目接種 7 日後以降の COVID-19 イベント発現に対するワクチンの有効性
(PP-EFF 解析対象集団)
本剤群
プラセボ群
例数
1,205
594
COVID-19 イベント発現数(%)
6(0.5)
14(2.4)
VE(%)[両側
a)
95%信頼区間] a)
79.54[46.83, 92.13]
VE 及び両側 95%信頼区間は modified Poisson regression により算出
なお、小児拡大パートの実施期間中に米国ではデルタ変異株が優勢であった。20 例の COVID19 イベントのうち 11 例で SARS-CoV-2 のウイルス株が同定され 、全例がデルタ変異株
(B.1.617.2 又は AY.3)であった。これらの特定されたデルタ変異株による COVID-19 イベン
トは本剤群 3 例(0.2%)及びプラセボ群 8 例(1.3%)に発現し、デルタ変異株に対する VE[両
側 95%信頼区間]は 82.04[32.42, 95.23]%であった。
免疫原性の主要評価項目とされた 2 回目接種後 14 日における従来株に対する中和抗体価の
成績は表 2 のとおりであり、事前に規定された基準に基づき、成人を対象としたメインスタデ
ィの 18~25 歳の被験者の同成績に対する非劣性が示された。なお、非劣性の基準は、1)両集
団における中和抗体価の幾何平均(以下「GMT」という。)の比(GMT18-<26yo/GMT12-<18yo)の
両側 95%信頼区間の上限値が 1.5 未満である、2)GMT の比の点推定値が 1.22 以下である、3)
両集団における抗体陽転率(以下「SCR」という。)の差(SCR18-<26yo–SCR12-<18yo)の両側 95%
信頼区間の上限値が 10%未満である、の 3 点がすべて達成された場合とされた。
18 歳以上を対象としたメインスタディと同一の主要評価項目であり、重症度の定義及び COVID-19 を疑う症状の定義
もメインスタディと同一であった(「令和 4 年 4 月 11 日付けヌバキソビッド筋注審査報告書」参照)。症候性の
COVID-19 は、発熱、咳あるいは 2 つ以上の COVID-19 関連症状を呈するものと定義された。
3)
ワクチンの有効性(VE)は、VE(%)=(1–RR)×100 と定義された。RR は本剤群とプラセボ群のイベント発生率の
相対的なリスク比。
2)
2
ヌバキソビッド筋注_武田薬品工業株式会社
例(1,414 例(94.8%)、702 例(92.9%))が治験継続中である。主な中止理由は同意撤回(53
例(3.6%)、39 例(5.2%))であった。また、141 例(89 例(6.0%)、52 例(6.9%))が盲検
解除され、盲検解除の主な理由は、既承認ワクチンの接種のため(60 例(4.0%)、40 例(5.3%))
であった。
データカットオフ時点で、PP-EFF 解析対象集団における 2 回目接種後 7 日以降の観察期間
(中央値)は、本剤群 64.0 日及びプラセボ群 63.0 日であった。各被験者の安全性については、
1 回目接種からクロスオーバー期間開始までのデータが評価され、安全性解析対象集団におけ
る 2 回目接種後の追跡調査期間(中央値)は本剤群、プラセボ群ともに 71 日であった。
有効性の主要評価項目とされた「ベースライン時に SARS-CoV-2 に対して血清学的陰性の被
験者における、PCR 検査で確定した症候性(軽症、中等症及び重症)の COVID-19 の最初の発
症」2)の結果は、PP-EFF 解析対象集団において表 1 のとおりであり、ワクチンの有効性3)(以
下「VE」という。)[両側 95%信頼区間]は 79.54[46.83, 92.13]%であった。認められた 20
例のイベントはすべて軽症であった。
表1
治験薬 2 回目接種 7 日後以降の COVID-19 イベント発現に対するワクチンの有効性
(PP-EFF 解析対象集団)
本剤群
プラセボ群
例数
1,205
594
COVID-19 イベント発現数(%)
6(0.5)
14(2.4)
VE(%)[両側
a)
95%信頼区間] a)
79.54[46.83, 92.13]
VE 及び両側 95%信頼区間は modified Poisson regression により算出
なお、小児拡大パートの実施期間中に米国ではデルタ変異株が優勢であった。20 例の COVID19 イベントのうち 11 例で SARS-CoV-2 のウイルス株が同定され 、全例がデルタ変異株
(B.1.617.2 又は AY.3)であった。これらの特定されたデルタ変異株による COVID-19 イベン
トは本剤群 3 例(0.2%)及びプラセボ群 8 例(1.3%)に発現し、デルタ変異株に対する VE[両
側 95%信頼区間]は 82.04[32.42, 95.23]%であった。
免疫原性の主要評価項目とされた 2 回目接種後 14 日における従来株に対する中和抗体価の
成績は表 2 のとおりであり、事前に規定された基準に基づき、成人を対象としたメインスタデ
ィの 18~25 歳の被験者の同成績に対する非劣性が示された。なお、非劣性の基準は、1)両集
団における中和抗体価の幾何平均(以下「GMT」という。)の比(GMT18-<26yo/GMT12-<18yo)の
両側 95%信頼区間の上限値が 1.5 未満である、2)GMT の比の点推定値が 1.22 以下である、3)
両集団における抗体陽転率(以下「SCR」という。)の差(SCR18-<26yo–SCR12-<18yo)の両側 95%
信頼区間の上限値が 10%未満である、の 3 点がすべて達成された場合とされた。
18 歳以上を対象としたメインスタディと同一の主要評価項目であり、重症度の定義及び COVID-19 を疑う症状の定義
もメインスタディと同一であった(「令和 4 年 4 月 11 日付けヌバキソビッド筋注審査報告書」参照)。症候性の
COVID-19 は、発熱、咳あるいは 2 つ以上の COVID-19 関連症状を呈するものと定義された。
3)
ワクチンの有効性(VE)は、VE(%)=(1–RR)×100 と定義された。RR は本剤群とプラセボ群のイベント発生率の
相対的なリスク比。
2)
2
ヌバキソビッド筋注_武田薬品工業株式会社