よむ、つかう、まなぶ。
試験の概要「ヌバキソビッド筋注」 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
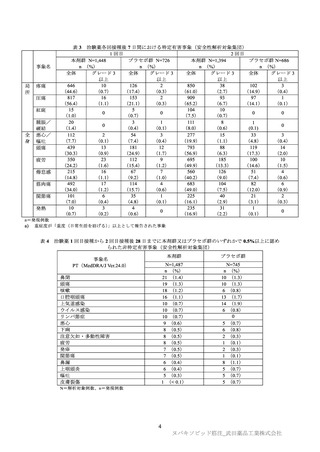
死亡例及び試験参加の中止に至った有害事象は認められなかった。治験薬の接種中止(2 回
目接種の中止)に至った有害事象は本剤群 1 例(若年性ミオクロニーてんかん)、プラセボ
群 1 例(鼻漏)に認められ、いずれも治験薬接種との因果関係が否定された。
重篤な有害事象は、本剤群 7 例(0.5%)、プラセボ群 2 例(0.3%)に認められ、いずれも
治験薬接種との因果関係が否定された。内訳は、本剤群では企図的過量投与 6)・痙攣発作、
企図的過量投与 7)・自殺企図、脾破裂、ノロウイルス性胃腸炎、限局性感染、若年性ミオク
ロニーてんかん、攻撃性(各 1 例)であり、プラセボ群では精神状態変化及び扁桃周囲膿瘍
(各 1 例)であった。
特に注目すべき有害事象として、潜在的な免疫介在性事象及び COVID-19 に特有の有害事
象8)が評価され、いずれも該当する事例は認められなかった。なお、治験実施計画書に規定
した潜在的な免疫介在性事象の定義に該当する事象として本剤群で痙攣発作 1 例が報告され
たが、本事象はフルオキセチンの過量投与によるものであり、潜在的な免疫介在性事象では
ないと治験責任医師により判断された。
中間報告書作成のためのデータ抽出時点(2021 年 10 月 6 日)までに、本剤接種後にアナ
フィラキシー反応 SMQ(狭域)に該当する事象を発現した症例は認められなかった。
なお、クロスオーバー期間ではあるものの、初回評価期間にプラセボ、クロスオーバー期
間に本剤を接種された 1 例(1 歳男性)において心筋炎が認められた。本症例では本剤 2 回
目接種後 2 日(本剤 1 回目接種後 42 日9))時点で重篤な心筋炎が認められ、治験責任医師に
より本剤との因果関係が否定できないとされたものの、併用薬(メチルフェニデート)やウ
イルス感染の影響も考えられた。転帰は軽快であった。
以上
フルオキセチン
アスピリン
8)
18 歳以上を対象としたメインスタディと同一の事象が既定された(「令和 4 年 4 月 11 日付けヌバキソビッド筋注審査
報告書」参照)。
9)
ウイルス症状のため、本剤の 2 回目接種が延期された。
6)
7)
5
ヌバキソビッド筋注_武田薬品工業株式会社
目接種の中止)に至った有害事象は本剤群 1 例(若年性ミオクロニーてんかん)、プラセボ
群 1 例(鼻漏)に認められ、いずれも治験薬接種との因果関係が否定された。
重篤な有害事象は、本剤群 7 例(0.5%)、プラセボ群 2 例(0.3%)に認められ、いずれも
治験薬接種との因果関係が否定された。内訳は、本剤群では企図的過量投与 6)・痙攣発作、
企図的過量投与 7)・自殺企図、脾破裂、ノロウイルス性胃腸炎、限局性感染、若年性ミオク
ロニーてんかん、攻撃性(各 1 例)であり、プラセボ群では精神状態変化及び扁桃周囲膿瘍
(各 1 例)であった。
特に注目すべき有害事象として、潜在的な免疫介在性事象及び COVID-19 に特有の有害事
象8)が評価され、いずれも該当する事例は認められなかった。なお、治験実施計画書に規定
した潜在的な免疫介在性事象の定義に該当する事象として本剤群で痙攣発作 1 例が報告され
たが、本事象はフルオキセチンの過量投与によるものであり、潜在的な免疫介在性事象では
ないと治験責任医師により判断された。
中間報告書作成のためのデータ抽出時点(2021 年 10 月 6 日)までに、本剤接種後にアナ
フィラキシー反応 SMQ(狭域)に該当する事象を発現した症例は認められなかった。
なお、クロスオーバー期間ではあるものの、初回評価期間にプラセボ、クロスオーバー期
間に本剤を接種された 1 例(1 歳男性)において心筋炎が認められた。本症例では本剤 2 回
目接種後 2 日(本剤 1 回目接種後 42 日9))時点で重篤な心筋炎が認められ、治験責任医師に
より本剤との因果関係が否定できないとされたものの、併用薬(メチルフェニデート)やウ
イルス感染の影響も考えられた。転帰は軽快であった。
以上
フルオキセチン
アスピリン
8)
18 歳以上を対象としたメインスタディと同一の事象が既定された(「令和 4 年 4 月 11 日付けヌバキソビッド筋注審査
報告書」参照)。
9)
ウイルス症状のため、本剤の 2 回目接種が延期された。
6)
7)
5
ヌバキソビッド筋注_武田薬品工業株式会社