よむ、つかう、まなぶ。
新旧対照表「ヌバキソビッド筋注」 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
添付文書改訂案(新旧対照表)
TAK-019
変更内容(下線部:変更箇所)
前
後
**2022 年 7 月改訂(第 3 版)
**2022 年 7 月改訂(第 4 版)
*2022 年 5 月改訂
*2022 年 7 月改訂
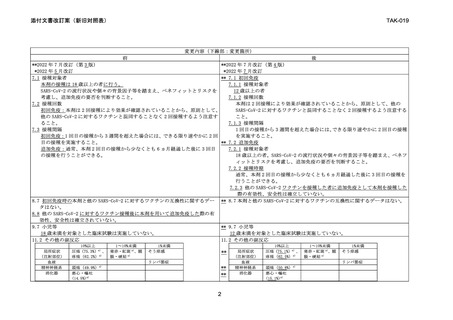
7.1 接種対象者
** 7.1 初回免疫
本剤の接種は 18 歳以上の者に行う。
7.1.1 接種対象者
SARS-CoV-2 の流行状況や個々の背景因子等を踏まえ、ベネフィットとリスクを
12 歳以上の者
考慮し、追加免疫の要否を判断すること。
7.1.2 接種回数
7.2 接種回数
本剤は 2 回接種により効果が確認されていることから、原則として、他の
SARS-CoV-2 に対するワクチンと混同することなく 2 回接種するよう注意する
初回免疫:本剤は 2 回接種により効果が確認されていることから、原則として、
こと。
他の SARS-CoV-2 に対するワクチンと混同することなく 2 回接種するよう注意す
7.1.3 接種間隔
ること。
7.3 接種間隔
1 回目の接種から 3 週間を超えた場合には、できる限り速やかに 2 回目の接種
を実施すること。
初回免疫:1 回目の接種から 3 週間を超えた場合には、できる限り速やかに 2 回
** 7.2 追加免疫
目の接種を実施すること。
追加免疫:通常、本剤 2 回目の接種から少なくとも 6 ヵ月経過した後に 3 回目
7.2.1 接種対象者
の接種を行うことができる。
18 歳以上の者。SARS-CoV-2 の流行状況や個々の背景因子等を踏まえ、ベネフ
ィットとリスクを考慮し、追加免疫の要否を判断すること。
7.2.2 接種時期
通常、本剤 2 回目の接種から少なくとも 6 ヵ月経過した後に 3 回目の接種を
行うことができる。
7.2.3 他の SARS-CoV-2 ワクチンを接種した者に追加免疫として本剤を接種した
際の有効性、安全性は確立していない。
8.7 初回免疫時の本剤と他の SARS-CoV-2 に対するワクチンの互換性に関するデー ** 8.7 本剤と他の SARS-CoV-2 に対するワクチンの互換性に関するデータはない。
タはない。
8.8 他の SARS-CoV-2 に対するワクチン接種後に本剤を用いて追加免疫した際の有
効性、安全性は確立されていない。
9.7 小児等
** 9.7 小児等
18 歳未満を対象とした臨床試験は実施していない。
12 歳未満を対象とした臨床試験は実施していない。
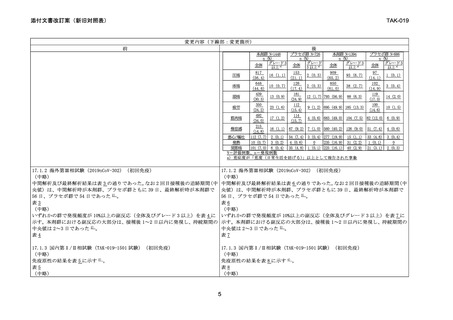
11.2 その他の副反応
11.2 その他の副反応
局所症状
(注射部位)
血液
精神神経系
消化器
10%以上
1~10%未満
圧痛(75.3%)a) 、 発赤・紅斑 a)、腫
疼痛(62.2%) a)
脹・硬結 a)
1%未満
そう痒感
**
リンパ節症
頭痛(49.9%) a)
悪心・嘔吐
(14.5%)a)
**
**
2
局所症状
(注射部位)
血液
精神神経系
消化器
10%以上
1~10%未満
圧痛(75.1%)a) 、 発赤・紅斑 a)、腫
疼痛(62.5%) a)
脹・硬結 a)
1%未満
そう痒感
リンパ節症
頭痛(50.8%) a)
悪心・嘔吐
(15.1%)a)
TAK-019
変更内容(下線部:変更箇所)
前
後
**2022 年 7 月改訂(第 3 版)
**2022 年 7 月改訂(第 4 版)
*2022 年 5 月改訂
*2022 年 7 月改訂
7.1 接種対象者
** 7.1 初回免疫
本剤の接種は 18 歳以上の者に行う。
7.1.1 接種対象者
SARS-CoV-2 の流行状況や個々の背景因子等を踏まえ、ベネフィットとリスクを
12 歳以上の者
考慮し、追加免疫の要否を判断すること。
7.1.2 接種回数
7.2 接種回数
本剤は 2 回接種により効果が確認されていることから、原則として、他の
SARS-CoV-2 に対するワクチンと混同することなく 2 回接種するよう注意する
初回免疫:本剤は 2 回接種により効果が確認されていることから、原則として、
こと。
他の SARS-CoV-2 に対するワクチンと混同することなく 2 回接種するよう注意す
7.1.3 接種間隔
ること。
7.3 接種間隔
1 回目の接種から 3 週間を超えた場合には、できる限り速やかに 2 回目の接種
を実施すること。
初回免疫:1 回目の接種から 3 週間を超えた場合には、できる限り速やかに 2 回
** 7.2 追加免疫
目の接種を実施すること。
追加免疫:通常、本剤 2 回目の接種から少なくとも 6 ヵ月経過した後に 3 回目
7.2.1 接種対象者
の接種を行うことができる。
18 歳以上の者。SARS-CoV-2 の流行状況や個々の背景因子等を踏まえ、ベネフ
ィットとリスクを考慮し、追加免疫の要否を判断すること。
7.2.2 接種時期
通常、本剤 2 回目の接種から少なくとも 6 ヵ月経過した後に 3 回目の接種を
行うことができる。
7.2.3 他の SARS-CoV-2 ワクチンを接種した者に追加免疫として本剤を接種した
際の有効性、安全性は確立していない。
8.7 初回免疫時の本剤と他の SARS-CoV-2 に対するワクチンの互換性に関するデー ** 8.7 本剤と他の SARS-CoV-2 に対するワクチンの互換性に関するデータはない。
タはない。
8.8 他の SARS-CoV-2 に対するワクチン接種後に本剤を用いて追加免疫した際の有
効性、安全性は確立されていない。
9.7 小児等
** 9.7 小児等
18 歳未満を対象とした臨床試験は実施していない。
12 歳未満を対象とした臨床試験は実施していない。
11.2 その他の副反応
11.2 その他の副反応
局所症状
(注射部位)
血液
精神神経系
消化器
10%以上
1~10%未満
圧痛(75.3%)a) 、 発赤・紅斑 a)、腫
疼痛(62.2%) a)
脹・硬結 a)
1%未満
そう痒感
**
リンパ節症
頭痛(49.9%) a)
悪心・嘔吐
(14.5%)a)
**
**
2
局所症状
(注射部位)
血液
精神神経系
消化器
10%以上
1~10%未満
圧痛(75.1%)a) 、 発赤・紅斑 a)、腫
疼痛(62.5%) a)
脹・硬結 a)
1%未満
そう痒感
リンパ節症
頭痛(50.8%) a)
悪心・嘔吐
(15.1%)a)