よむ、つかう、まなぶ。
新旧対照表「ヌバキソビッド筋注」 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
添付文書改訂案(新旧対照表)
TAK-019
変更内容(下線部:変更箇所)
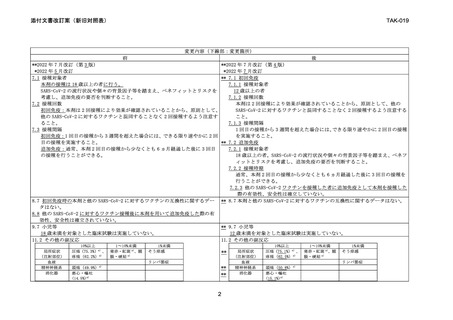
前
皮膚
後
発疹、紅斑、
そう痒症、じん麻
疹
筋・骨格系
筋肉痛(51.0%)
a)
、
関節痛(23.9%)a)
その他
疲労(52.9%)a) 、 発熱 a) 、四肢痛
悪寒
倦怠感(41.0%)a)
a) 臨床試験において電子日誌により収集した副反応の発現頻度
皮膚
**
**
発疹、紅斑、
そう痒症、じん麻
疹
筋・骨格系
筋肉痛(51.4%)
、
関節痛(23.6%)a)
その他
疲労(53.0%)a) 、 発熱 a) 、四肢痛
悪寒
倦怠感(41.1%)a)
a) 臨床試験において電子日誌により収集した副反応の発現頻度
a)
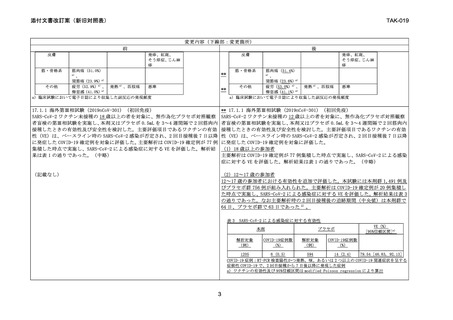
17.1.1 海外第Ⅲ相試験(2019nCoV-301)(初回免疫)
SARS-CoV-2 ワクチン未接種の 18 歳以上の者を対象に、無作為化プラセボ対照観察
者盲検の第Ⅲ相試験を実施し、本剤又はプラセボ 0.5mL を 3~4 週間隔で 2 回筋肉内
接種したときの有効性及び安全性を検討した。主要評価項目であるワクチンの有効
性(VE)は、ベースライン時の SARS-CoV-2 感染が否定され、2 回目接種後 7 日以降
に発症した COVID-19 確定例を対象に評価した。主要解析は COVID-19 確定例が 77 例
集積した時点で実施し、SARS-CoV-2 による感染症に対する VE を評価した。解析結
果は表 1 の通りであった。(中略)
** 17.1.1 海外第Ⅲ相試験(2019nCoV-301)(初回免疫)
SARS-CoV-2 ワクチン未接種の 12 歳以上の者を対象に、無作為化プラセボ対照観察
者盲検の第Ⅲ相試験を実施し、本剤又はプラセボ 0.5mL を 3~4 週間隔で 2 回筋肉内
接種したときの有効性及び安全性を検討した。主要評価項目であるワクチンの有効
性(VE)は、ベースライン時の SARS-CoV-2 感染が否定され、2 回目接種後 7 日以降
に発症した COVID-19 確定例を対象に評価した。
(1)18 歳以上の参加者
主要解析は COVID-19 確定例が 77 例集積した時点で実施し、SARS-CoV-2 による感染
症に対する VE を評価した。解析結果は表 1 の通りであった。(中略)
(記載なし)
(2)12~17 歳の参加者
12~17 歳の参加者における有効性を追加で評価した。本試験には本剤群 1,491 例及
びプラセボ群 756 例が組み入れられた。主要解析は COVID-19 確定例が 20 例集積し
た時点で実施し、SARS-CoV-2 による感染症に対する VE を評価した。解析結果は表 3
の通りであった。なお主要解析時の 2 回目接種後の追跡期間(中央値)は本剤群で
64 日、プラセボ群で 63 日であった 2) 。
表3
SARS-CoV-2 による感染症に対する有効性
本剤
プラセボ
解析対象
(例)
COVID-19症例数
(%)
解析対象
(例)
COVID-19症例数
(%)
1205
6 (0.5)
594
14 (2.4)
VE(%)
[95%信頼区間]a)
79.54 [46.83, 92.13]
COVID-19 症例:RT-PCR 検査陽性かつ発熱、咳、あるいは 2 つ以上の COVID-19 関連症状を呈する
症候性 COVID-19 で、2 回目接種から 7 日後以降に発現した症例
a)ワクチンの有効性及び 95%信頼区間は modified Poisson regression により算出
3
TAK-019
変更内容(下線部:変更箇所)
前
皮膚
後
発疹、紅斑、
そう痒症、じん麻
疹
筋・骨格系
筋肉痛(51.0%)
a)
、
関節痛(23.9%)a)
その他
疲労(52.9%)a) 、 発熱 a) 、四肢痛
悪寒
倦怠感(41.0%)a)
a) 臨床試験において電子日誌により収集した副反応の発現頻度
皮膚
**
**
発疹、紅斑、
そう痒症、じん麻
疹
筋・骨格系
筋肉痛(51.4%)
、
関節痛(23.6%)a)
その他
疲労(53.0%)a) 、 発熱 a) 、四肢痛
悪寒
倦怠感(41.1%)a)
a) 臨床試験において電子日誌により収集した副反応の発現頻度
a)
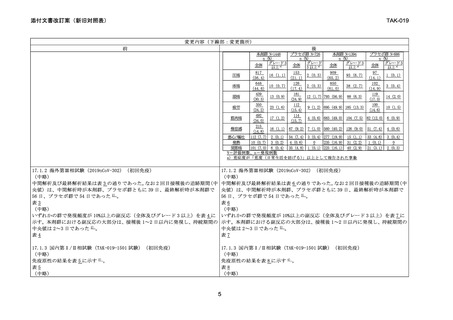
17.1.1 海外第Ⅲ相試験(2019nCoV-301)(初回免疫)
SARS-CoV-2 ワクチン未接種の 18 歳以上の者を対象に、無作為化プラセボ対照観察
者盲検の第Ⅲ相試験を実施し、本剤又はプラセボ 0.5mL を 3~4 週間隔で 2 回筋肉内
接種したときの有効性及び安全性を検討した。主要評価項目であるワクチンの有効
性(VE)は、ベースライン時の SARS-CoV-2 感染が否定され、2 回目接種後 7 日以降
に発症した COVID-19 確定例を対象に評価した。主要解析は COVID-19 確定例が 77 例
集積した時点で実施し、SARS-CoV-2 による感染症に対する VE を評価した。解析結
果は表 1 の通りであった。(中略)
** 17.1.1 海外第Ⅲ相試験(2019nCoV-301)(初回免疫)
SARS-CoV-2 ワクチン未接種の 12 歳以上の者を対象に、無作為化プラセボ対照観察
者盲検の第Ⅲ相試験を実施し、本剤又はプラセボ 0.5mL を 3~4 週間隔で 2 回筋肉内
接種したときの有効性及び安全性を検討した。主要評価項目であるワクチンの有効
性(VE)は、ベースライン時の SARS-CoV-2 感染が否定され、2 回目接種後 7 日以降
に発症した COVID-19 確定例を対象に評価した。
(1)18 歳以上の参加者
主要解析は COVID-19 確定例が 77 例集積した時点で実施し、SARS-CoV-2 による感染
症に対する VE を評価した。解析結果は表 1 の通りであった。(中略)
(記載なし)
(2)12~17 歳の参加者
12~17 歳の参加者における有効性を追加で評価した。本試験には本剤群 1,491 例及
びプラセボ群 756 例が組み入れられた。主要解析は COVID-19 確定例が 20 例集積し
た時点で実施し、SARS-CoV-2 による感染症に対する VE を評価した。解析結果は表 3
の通りであった。なお主要解析時の 2 回目接種後の追跡期間(中央値)は本剤群で
64 日、プラセボ群で 63 日であった 2) 。
表3
SARS-CoV-2 による感染症に対する有効性
本剤
プラセボ
解析対象
(例)
COVID-19症例数
(%)
解析対象
(例)
COVID-19症例数
(%)
1205
6 (0.5)
594
14 (2.4)
VE(%)
[95%信頼区間]a)
79.54 [46.83, 92.13]
COVID-19 症例:RT-PCR 検査陽性かつ発熱、咳、あるいは 2 つ以上の COVID-19 関連症状を呈する
症候性 COVID-19 で、2 回目接種から 7 日後以降に発現した症例
a)ワクチンの有効性及び 95%信頼区間は modified Poisson regression により算出
3