よむ、つかう、まなぶ。
新旧対照表「ヌバキソビッド筋注」 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
添付文書改訂案(新旧対照表)
TAK-019
変更内容(下線部:変更箇所)
前
後
本剤群 N=1448
プラセボ群 N=726
本剤群 N=1394
n(%)
n(%)
n(%)
グレード 3
グレード
グレード 3
全体
全体
全体
以上 a)
3 以上 a)
以上 a)
817
153
909
圧痛
16 (1.1)
2 (0.3)
93 (6.7)
(56.4)
(21.1)
(65.2)
646
126
850
疼痛
10 (0.7)
2 (0.3)
38 (2.7)
(44.6)
(17.4)
(61.0)
439
181
頭痛
13 (0.9)
12 (1.7) 793 (56.9) 88 (6.3)
(30.3)
(24.9)
350
112
疲労
23 (1.6)
9 (1.2) 695 (49.9) 185 (13.3)
(24.2)
(15.4)
492
114
筋肉痛
17 (1.2)
4 (0.6) 683 (49.0) 104 (7.5)
(34.0)
(15.7)
215
倦怠感
16 (1.1) 67 (9.2) 7 (1.0) 560 (40.2) 126 (9.0)
(14.8)
悪心/嘔吐 112 (7.7) 2 (0.1) 54 (7.4) 3 (0.4) 277 (19.9) 15 (1.1)
発熱
10 (0.7) 3 (0.2) 4 (0.6)
0
235 (16.9) 31 (2.2)
関節痛
101 (7.0) 6 (0.4) 35 (4.8) 1 (0.1) 225 (16.1) 40 (2.9)
N=評価例数、n=発現例数
a)重症度が「重度(日常生活を妨げる)」以上として報告された事象
プラセボ群 N=686
n(%)
グレード 3
全体
以上 a)
97
1 (0.1)
(14.1)
102
3 (0.4)
(14.9)
119
14 (2.0)
(17.3)
100
10 (1.5)
(14.6)
82 (12.0) 6 (0.9)
51 (7.4)
4 (0.6)
33 (4.8)
1 (0.1)
21 (3.1)
3 (0.4)
0
2 (0.3)
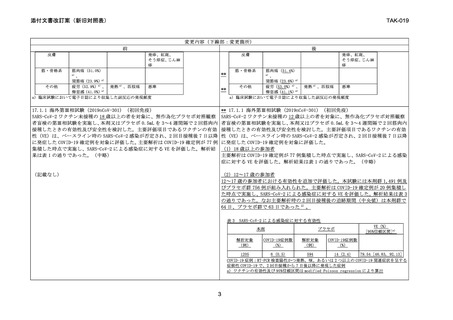
17.1.2 海外第Ⅲ相試験(2019nCoV-302)(初回免疫)
(中略)
中間解析及び最終解析結果は表 3 の通りであった。なお 2 回目接種後の追跡期間(中
央値)は、中間解析時が本剤群、プラセボ群ともに 39 日、最終解析時が本剤群で
56 日、プラセボ群で 54 日であった 2) 。
表3
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 4 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 2) 。
表4
17.1.2 海外第Ⅲ相試験(2019nCoV-302)(初回免疫)
(中略)
中間解析及び最終解析結果は表 6 の通りであった。なお 2 回目接種後の追跡期間(中
央値)は、中間解析時が本剤群、プラセボ群ともに 39 日、最終解析時が本剤群で
56 日、プラセボ群で 54 日であった 3) 。
表6
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 7 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 3) 。
表7
17.1.3 国内第Ⅰ/Ⅱ相試験(TAK-019-1501 試験)(初回免疫)
(中略)
免疫原性の結果を表 5 に示す 3) 。
表5
(中略)
17.1.3 国内第Ⅰ/Ⅱ相試験(TAK-019-1501 試験)(初回免疫)
(中略)
免疫原性の結果を表 8 に示す 4) 。
表8
(中略)
5
TAK-019
変更内容(下線部:変更箇所)
前
後
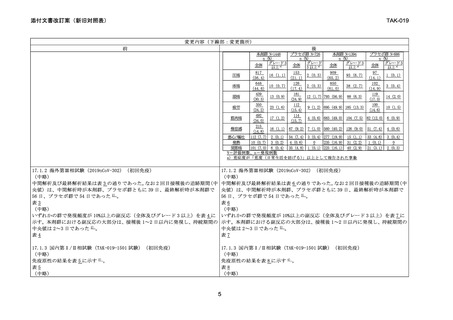
本剤群 N=1448
プラセボ群 N=726
本剤群 N=1394
n(%)
n(%)
n(%)
グレード 3
グレード
グレード 3
全体
全体
全体
以上 a)
3 以上 a)
以上 a)
817
153
909
圧痛
16 (1.1)
2 (0.3)
93 (6.7)
(56.4)
(21.1)
(65.2)
646
126
850
疼痛
10 (0.7)
2 (0.3)
38 (2.7)
(44.6)
(17.4)
(61.0)
439
181
頭痛
13 (0.9)
12 (1.7) 793 (56.9) 88 (6.3)
(30.3)
(24.9)
350
112
疲労
23 (1.6)
9 (1.2) 695 (49.9) 185 (13.3)
(24.2)
(15.4)
492
114
筋肉痛
17 (1.2)
4 (0.6) 683 (49.0) 104 (7.5)
(34.0)
(15.7)
215
倦怠感
16 (1.1) 67 (9.2) 7 (1.0) 560 (40.2) 126 (9.0)
(14.8)
悪心/嘔吐 112 (7.7) 2 (0.1) 54 (7.4) 3 (0.4) 277 (19.9) 15 (1.1)
発熱
10 (0.7) 3 (0.2) 4 (0.6)
0
235 (16.9) 31 (2.2)
関節痛
101 (7.0) 6 (0.4) 35 (4.8) 1 (0.1) 225 (16.1) 40 (2.9)
N=評価例数、n=発現例数
a)重症度が「重度(日常生活を妨げる)」以上として報告された事象
プラセボ群 N=686
n(%)
グレード 3
全体
以上 a)
97
1 (0.1)
(14.1)
102
3 (0.4)
(14.9)
119
14 (2.0)
(17.3)
100
10 (1.5)
(14.6)
82 (12.0) 6 (0.9)
51 (7.4)
4 (0.6)
33 (4.8)
1 (0.1)
21 (3.1)
3 (0.4)
0
2 (0.3)
17.1.2 海外第Ⅲ相試験(2019nCoV-302)(初回免疫)
(中略)
中間解析及び最終解析結果は表 3 の通りであった。なお 2 回目接種後の追跡期間(中
央値)は、中間解析時が本剤群、プラセボ群ともに 39 日、最終解析時が本剤群で
56 日、プラセボ群で 54 日であった 2) 。
表3
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 4 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 2) 。
表4
17.1.2 海外第Ⅲ相試験(2019nCoV-302)(初回免疫)
(中略)
中間解析及び最終解析結果は表 6 の通りであった。なお 2 回目接種後の追跡期間(中
央値)は、中間解析時が本剤群、プラセボ群ともに 39 日、最終解析時が本剤群で
56 日、プラセボ群で 54 日であった 3) 。
表6
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 7 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 3) 。
表7
17.1.3 国内第Ⅰ/Ⅱ相試験(TAK-019-1501 試験)(初回免疫)
(中略)
免疫原性の結果を表 5 に示す 3) 。
表5
(中略)
17.1.3 国内第Ⅰ/Ⅱ相試験(TAK-019-1501 試験)(初回免疫)
(中略)
免疫原性の結果を表 8 に示す 4) 。
表8
(中略)
5