よむ、つかう、まなぶ。
新旧対照表「ヌバキソビッド筋注」 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
添付文書改訂案(新旧対照表)
TAK-019
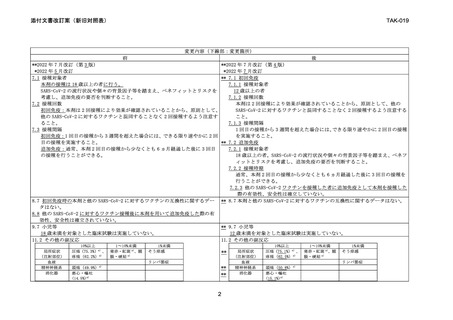
変更内容(下線部:変更箇所)
前
後
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 6 に いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 9 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の 示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 3) 。
中央値は 2~3 日であった 4) 。
表6
表9
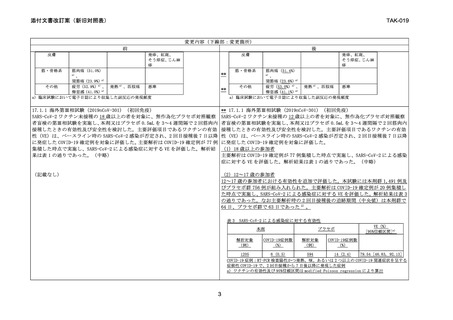
17.1.4 海外第Ⅰ/Ⅱ相試験(2019nCoV-101 試験 第 2 相パート)(追加免疫)
(中略)
追加免疫として本剤を 1 回接種した群及びプラセボを 1 回接種した群の 4 週後の野
生型ウイルスに対する血清中和抗体価の幾何平均はそれぞれ 6023.2 及び 65.0、ベ
ースラインを追加免疫の接種直前とした幾何平均増加倍率はそれぞれ 86.7 倍及び
1.0 倍、ベースラインを追加免疫の接種直前とした抗体陽転率はそれぞれ 95.3%及び
11.9%であった 4) 。
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 7 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 1.0~2.5 日であった 4) 。
表7
23. 主要文献
1)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.2)(社内資料)
2)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.3)(社内資料)
3)国内第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.1)(社内資料)
4)海外第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.4)(社内資料)
17.1.4 海外第Ⅰ/Ⅱ相試験(2019nCoV-101 試験 第 2 相パート)(追加免疫)
(中略)
追加免疫として本剤を 1 回接種した群及びプラセボを 1 回接種した群の 4 週後の野
生型ウイルスに対する血清中和抗体価の幾何平均はそれぞれ 6023.2 及び 65.0、ベ
ースラインを追加免疫の接種直前とした幾何平均増加倍率はそれぞれ 86.7 倍及び
1.0 倍、ベースラインを追加免疫の接種直前とした抗体陽転率はそれぞれ 95.3%及び
11.9%であった 5) 。
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 10 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 1.0~2.5 日であった 5) 。
表 10
** 23. 主要文献
1)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.2)
2)海外第Ⅲ相試験(社内資料)
3)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.3)
4)国内第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.1)
5)海外第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.4)
下線部:変更箇所
以上
6
TAK-019
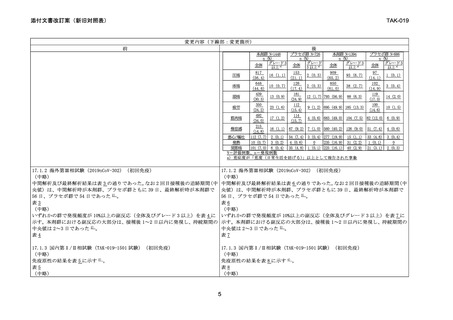
変更内容(下線部:変更箇所)
前
後
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 6 に いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 9 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の 示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 2~3 日であった 3) 。
中央値は 2~3 日であった 4) 。
表6
表9
17.1.4 海外第Ⅰ/Ⅱ相試験(2019nCoV-101 試験 第 2 相パート)(追加免疫)
(中略)
追加免疫として本剤を 1 回接種した群及びプラセボを 1 回接種した群の 4 週後の野
生型ウイルスに対する血清中和抗体価の幾何平均はそれぞれ 6023.2 及び 65.0、ベ
ースラインを追加免疫の接種直前とした幾何平均増加倍率はそれぞれ 86.7 倍及び
1.0 倍、ベースラインを追加免疫の接種直前とした抗体陽転率はそれぞれ 95.3%及び
11.9%であった 4) 。
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 7 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 1.0~2.5 日であった 4) 。
表7
23. 主要文献
1)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.2)(社内資料)
2)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.3)(社内資料)
3)国内第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.1)(社内資料)
4)海外第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.4)(社内資料)
17.1.4 海外第Ⅰ/Ⅱ相試験(2019nCoV-101 試験 第 2 相パート)(追加免疫)
(中略)
追加免疫として本剤を 1 回接種した群及びプラセボを 1 回接種した群の 4 週後の野
生型ウイルスに対する血清中和抗体価の幾何平均はそれぞれ 6023.2 及び 65.0、ベ
ースラインを追加免疫の接種直前とした幾何平均増加倍率はそれぞれ 86.7 倍及び
1.0 倍、ベースラインを追加免疫の接種直前とした抗体陽転率はそれぞれ 95.3%及び
11.9%であった 5) 。
(中略)
いずれかの群で発現頻度が 10%以上の副反応(全体及びグレード 3 以上)を表 10 に
示す。本剤群における副反応の大部分は、接種後 1~2 日以内に発現し、持続期間の
中央値は 1.0~2.5 日であった 5) 。
表 10
** 23. 主要文献
1)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.2)
2)海外第Ⅲ相試験(社内資料)
3)海外第Ⅲ相試験(2022 年 4 月 19 日承認、CTD2.7.6.3)
4)国内第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.1)
5)海外第Ⅰ/Ⅱ相試験(2022 年 4 月 19 日承認、CTD2.7.6.4)
下線部:変更箇所
以上
6