よむ、つかう、まなぶ。
新旧対照表「ヌバキソビッド筋注」 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26943.html |
| 出典情報 | 薬事・食品衛生審議会 医薬品第二部会 資料(7/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
添付文書改訂案(新旧対照表)
TAK-019
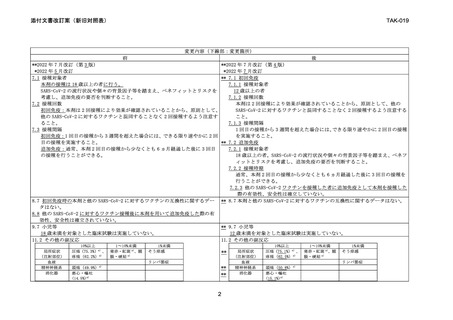
変更内容(下線部:変更箇所)
前
後
免疫原性は、ベースライン時の SARS-CoV-2 感染が否定され、規定された 2 回目接種
を受けた本剤群の 390 例を対象に評価し、17.1.1 海外第Ⅲ相試験の本剤群のうち 18
~25 歳の被験者データと比較した。本剤 2 回目接種から 14 日後の野生型ウイルス
に対する血清中和抗体価及び抗体陽転率は表 4 の通りであり、12~17 歳の 18~25
歳に対する非劣性が確認された a)。
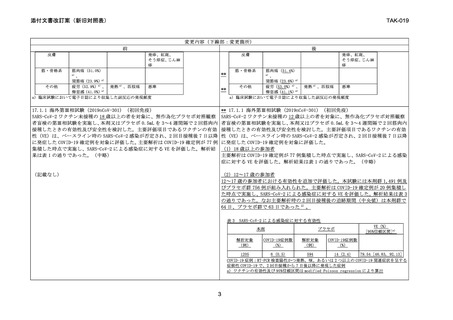
表4
2 回目接種 14 日後の野生型ウイルスに対する血清中和抗体価及び抗体陽転率
年齢
12~17歳
GMT
N
[両側
95%CI]
血清中和
抗体価 b)
3859.6
390
[3422.8,
4352.1]
%
n/N
[両側
95%CI]
抗体陽転
率 d)
98.7
385/390
[97.0,
99.6]
18~25歳
GMT
N
[両側
95%CI ]
2633.6
416
[2388.6,
2903.6]
%
n/N
[両側
95%CI]
99.8
415/416
[98.7,
100.0]
GMRc)
[両側95%CI]
(18~25歳
vs 12~17歳)
0.7
[0.6, 0.8]
抗体陽転率の差
[両側95%CIe)]
1.1
[-0.2, 2.8]
N=評価例数、n=抗体陽転がみられた被験者数
CI: 信頼区間; GMT: 幾何平均抗体価; GMR: 幾何平均比
a)以下の 3 点がすべて達成された場合に非劣性が示されるものと事前に規定した。
i)GMR(GMT18~25 歳 /GMT12~17 歳 )の両側 95% CI の上限値が 1.5 未満
ii)GMR の点推定値が 1.22(1.5 の平方根)以下
iii)抗体陽転率(SCR)の差(SCR18~25 歳 –SCR12~17 歳 )の両側 95% CI の上限値が 10%未満
b)抗体価が LLOQ 未満の場合、解析には 0.5×LLOQ の値を用いた。
c)接種群を要因、ベースラインの抗体価を共変量とした ANCOVA
d)抗体価がベースラインから 4 倍以上増加した被験者の割合
e)Miettinen and Nurminen 法
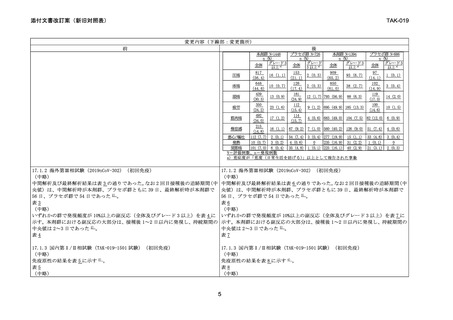
安全性は少なくとも 1 回接種した 2,232 例で評価し、各接種後 7 日間は電子日誌に
より副反応を収集した。いずれかの群で発現頻度が 10%以上の副反応(全体及びグ
レード 3 以上)を表 5 に示す。本剤群における副反応の大部分は、接種後 1~2 日以
内に発現し、持続期間の中央値は 1~2 日であった 2) 。
表5
主な副反応の発現状況
1 回目
4
2 回目
TAK-019
変更内容(下線部:変更箇所)
前
後
免疫原性は、ベースライン時の SARS-CoV-2 感染が否定され、規定された 2 回目接種
を受けた本剤群の 390 例を対象に評価し、17.1.1 海外第Ⅲ相試験の本剤群のうち 18
~25 歳の被験者データと比較した。本剤 2 回目接種から 14 日後の野生型ウイルス
に対する血清中和抗体価及び抗体陽転率は表 4 の通りであり、12~17 歳の 18~25
歳に対する非劣性が確認された a)。
表4
2 回目接種 14 日後の野生型ウイルスに対する血清中和抗体価及び抗体陽転率
年齢
12~17歳
GMT
N
[両側
95%CI]
血清中和
抗体価 b)
3859.6
390
[3422.8,
4352.1]
%
n/N
[両側
95%CI]
抗体陽転
率 d)
98.7
385/390
[97.0,
99.6]
18~25歳
GMT
N
[両側
95%CI ]
2633.6
416
[2388.6,
2903.6]
%
n/N
[両側
95%CI]
99.8
415/416
[98.7,
100.0]
GMRc)
[両側95%CI]
(18~25歳
vs 12~17歳)
0.7
[0.6, 0.8]
抗体陽転率の差
[両側95%CIe)]
1.1
[-0.2, 2.8]
N=評価例数、n=抗体陽転がみられた被験者数
CI: 信頼区間; GMT: 幾何平均抗体価; GMR: 幾何平均比
a)以下の 3 点がすべて達成された場合に非劣性が示されるものと事前に規定した。
i)GMR(GMT18~25 歳 /GMT12~17 歳 )の両側 95% CI の上限値が 1.5 未満
ii)GMR の点推定値が 1.22(1.5 の平方根)以下
iii)抗体陽転率(SCR)の差(SCR18~25 歳 –SCR12~17 歳 )の両側 95% CI の上限値が 10%未満
b)抗体価が LLOQ 未満の場合、解析には 0.5×LLOQ の値を用いた。
c)接種群を要因、ベースラインの抗体価を共変量とした ANCOVA
d)抗体価がベースラインから 4 倍以上増加した被験者の割合
e)Miettinen and Nurminen 法
安全性は少なくとも 1 回接種した 2,232 例で評価し、各接種後 7 日間は電子日誌に
より副反応を収集した。いずれかの群で発現頻度が 10%以上の副反応(全体及びグ
レード 3 以上)を表 5 に示す。本剤群における副反応の大部分は、接種後 1~2 日以
内に発現し、持続期間の中央値は 1~2 日であった 2) 。
表5
主な副反応の発現状況
1 回目
4
2 回目