よむ、つかう、まなぶ。
別紙3○【先進医療会議】先進医療Bの総括報告書に関する評価について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00050.html |
| 出典情報 | 先進医療会議(第114回先進医療会議、第138回先進医療技術審査部会 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
副担当: 上村(夕)構成員
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
コメント欄:
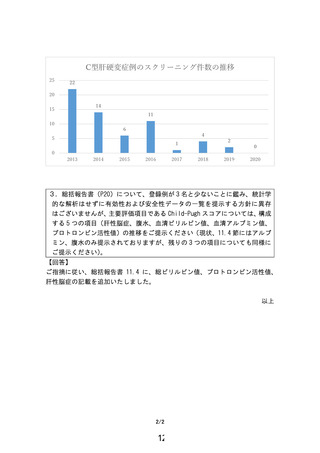
本試験では、主要評価項目を「24 週の時点で Child-Pugh Score の 1 点以上改善
する割合」と設定し、投与群の改善割合が標準的治療群の割合以下であるという帰
無仮説を片側有意水準 0.025 で検定している試験です。Child-Pugh Score1 点以上
の改善割合を治療群で 52.9%、対照群で 5.9%を想定し、検出力 0.80 のもと各群 17
例、合計 34 例を目標症例数として設定した計画の下、試験が実施されました。
一方で、本試験開始後に直接作用型抗ウイルス薬(DAA)が承認され、2019 年 2 月
から C 型非代償性肝硬変におけるウイルス血症の改善を適応とするソホスブビ
ル・ベルパタスビルが承認されたことも影響し、実際に登録された人数は、投与群
に 2 名、標準治療群に 1 名でした。また、24 週時のスコアは 3 名ともベースライ
ン時のスコアから変動はなく、いずれの群においても改善した症例はいないとの
結果であり、これらを踏まえると、本研究で得られた結果をもって従来の医療技術
と比較した有効性の評価をすることは困難と考えます。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
D.その他
コメント欄:
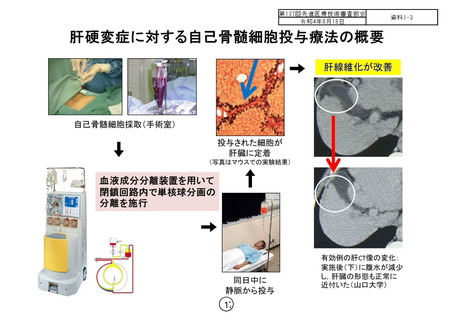
本治療の手技により患者細胞投与群 2 例において貧血を認めています。また、因
果関係のある重篤な有害事象は認められませんでしたが、投与例は 2 名のみであ
ることから、本試験結果から安全性に関して判断を下すことは困難と考えます。
5
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
コメント欄:
本試験では、主要評価項目を「24 週の時点で Child-Pugh Score の 1 点以上改善
する割合」と設定し、投与群の改善割合が標準的治療群の割合以下であるという帰
無仮説を片側有意水準 0.025 で検定している試験です。Child-Pugh Score1 点以上
の改善割合を治療群で 52.9%、対照群で 5.9%を想定し、検出力 0.80 のもと各群 17
例、合計 34 例を目標症例数として設定した計画の下、試験が実施されました。
一方で、本試験開始後に直接作用型抗ウイルス薬(DAA)が承認され、2019 年 2 月
から C 型非代償性肝硬変におけるウイルス血症の改善を適応とするソホスブビ
ル・ベルパタスビルが承認されたことも影響し、実際に登録された人数は、投与群
に 2 名、標準治療群に 1 名でした。また、24 週時のスコアは 3 名ともベースライ
ン時のスコアから変動はなく、いずれの群においても改善した症例はいないとの
結果であり、これらを踏まえると、本研究で得られた結果をもって従来の医療技術
と比較した有効性の評価をすることは困難と考えます。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
D.その他
コメント欄:
本治療の手技により患者細胞投与群 2 例において貧血を認めています。また、因
果関係のある重篤な有害事象は認められませんでしたが、投与例は 2 名のみであ
ることから、本試験結果から安全性に関して判断を下すことは困難と考えます。
5