よむ、つかう、まなぶ。
資料3-2―② 鈴木先生提出資料 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00395.html |
| 出典情報 | 新型コロナウイルス感染症対策アドバイザリーボード (第110回 12/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
新型コロナワクチンの有効性を検討した症例対照研究の暫定報告(第五報)
:オミクロン対応 2 価
ワクチンの有効性
2022 年 12 月 13 日
端緒
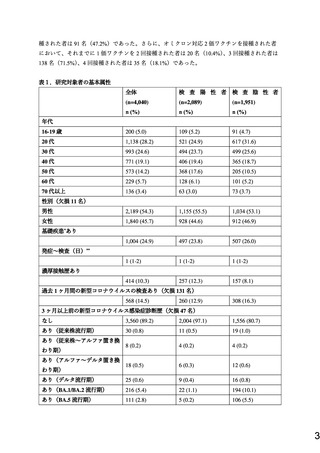
新型コロナウイルス感染症(COVID-19)に対するワクチンの開発は未曾有のスピードで進み、
ファイザー社製およびモデルナ社製の mRNA ワクチンは大規模なランダム化比較試験で高い有
効性(vaccine efficacy)が示された 1-3。国内においても、国立感染症研究所にて、複数の医療機
関や民間検査会社の協力のもとで、発熱外来等で新型コロナウイルスの検査を受ける者を対象
として、症例対照研究(test-negative design)を実施し、実社会における有効性(vaccine
effectiveness;発症予防効果)を検討している。これまでの暫定報告においては、B.1.1.7 系統
(アルファ)および B.1.617.2 系統(デルタ)に対して、高い有効性を示すことが確認された一
方で 4-5、2021 年末に出現したオミクロンにおいては、発症予防効果が一定程度みられたもの
の、相対的に低く、免疫の減衰も示唆された 6-8。こうした中で、ファイザー社およびモデルナ
社は、オミクロンの亜系統である BA.1 および BA.4-5 にそれぞれ対応した 2 種類のオミクロン
対応 2 価ワクチン(以下、オミクロン対応 2 価ワクチン(BA.1)およびオミクロン対応 2 価ワ
クチン(BA.4-5))を開発し、国内においてこれらが承認され、接種が開始された 9-10。ファイザ
ー社製およびモデルナ社製のオミクロン対応 2 価ワクチン(BA.1)は 9 月 20 日に、ファイザー
社製のオミクロン対応 2 価ワクチン(BA.4-5)は 10 月 13 日に、モデルナ社製のオミクロン対
応 2 価ワクチン(BA.4-5)は 11 月 28 日に、それぞれ接種が開始されている 9-10。そこで今回
は、2 価ワクチンの接種が開始された 9 月 20 日から 11 月 30 日の調査における暫定結果を報告
する。なお同時期には、関東地方において、BA.5 が 75-90%以上を占めるとされた 11。
方法
2022 年 9 月 20 日から 11 月 30 日までに関東地方の複数医療機関の発熱外来等を受診した 16 歳
以上の者(一部医療機関では成人)を対象に、検査前に基本属性、新型コロナワクチン接種歴
などを含む問診票に記載いただいた。意識障害のある者、直ちに治療が必要な者、日本語での
問診票に回答できない者には問診票の配布を行わなかった。のちに各医療機関で新型コロナウ
イルス感染症の診断目的に実施している核酸検査(PCR)の検査結果が判明した際に検査陽性者
を症例群(ケース)
、検査陰性者を対照群(コントロール)と分類した。発症から 14 日以内
で、37.5℃以上の発熱、全身倦怠感、寒気、関節痛、頭痛、鼻汁、咳嗽、咽頭痛、呼吸困難感、
嘔気・下痢・腹痛、嗅覚味覚障害のいずれか 1 症状のある者に限定して解析を行うこととし
た。また、期間中にすでに受診した記録のある者は本解析においては除外した。解析に際し
て、製造会社の区別はせず、mRNA ワクチン以外を一度でも接種された者、接種されたワクチ
ンの種類が一回でも不明であった者は除外した。
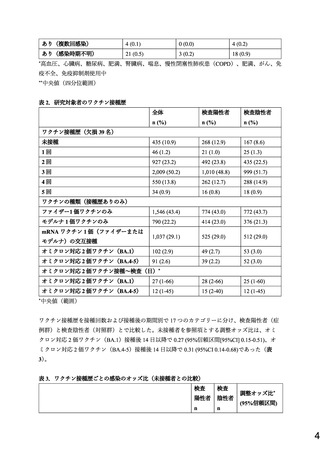
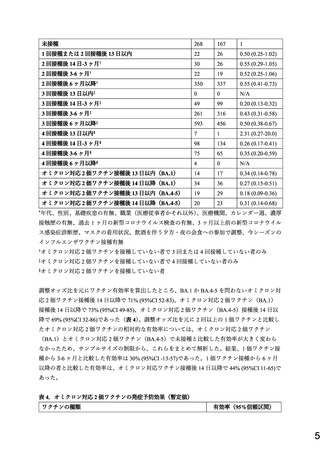
ワクチン接種歴については、(1)未接種、
(2)1 回接種または 2 回接種から 13 日以内、
(3)
2 回接種から 14 日-3 ヶ月(14-90 日)、
(4)2 回接種から 3-6 ヶ月(91-180 日)、(5)2 回接種
から 6 ヶ月以降(181 日以降)
、
(6)3 回接種から 13 日以内、(7)3 回接種から 14 日-3 ヶ月
1
:オミクロン対応 2 価
ワクチンの有効性
2022 年 12 月 13 日
端緒
新型コロナウイルス感染症(COVID-19)に対するワクチンの開発は未曾有のスピードで進み、
ファイザー社製およびモデルナ社製の mRNA ワクチンは大規模なランダム化比較試験で高い有
効性(vaccine efficacy)が示された 1-3。国内においても、国立感染症研究所にて、複数の医療機
関や民間検査会社の協力のもとで、発熱外来等で新型コロナウイルスの検査を受ける者を対象
として、症例対照研究(test-negative design)を実施し、実社会における有効性(vaccine
effectiveness;発症予防効果)を検討している。これまでの暫定報告においては、B.1.1.7 系統
(アルファ)および B.1.617.2 系統(デルタ)に対して、高い有効性を示すことが確認された一
方で 4-5、2021 年末に出現したオミクロンにおいては、発症予防効果が一定程度みられたもの
の、相対的に低く、免疫の減衰も示唆された 6-8。こうした中で、ファイザー社およびモデルナ
社は、オミクロンの亜系統である BA.1 および BA.4-5 にそれぞれ対応した 2 種類のオミクロン
対応 2 価ワクチン(以下、オミクロン対応 2 価ワクチン(BA.1)およびオミクロン対応 2 価ワ
クチン(BA.4-5))を開発し、国内においてこれらが承認され、接種が開始された 9-10。ファイザ
ー社製およびモデルナ社製のオミクロン対応 2 価ワクチン(BA.1)は 9 月 20 日に、ファイザー
社製のオミクロン対応 2 価ワクチン(BA.4-5)は 10 月 13 日に、モデルナ社製のオミクロン対
応 2 価ワクチン(BA.4-5)は 11 月 28 日に、それぞれ接種が開始されている 9-10。そこで今回
は、2 価ワクチンの接種が開始された 9 月 20 日から 11 月 30 日の調査における暫定結果を報告
する。なお同時期には、関東地方において、BA.5 が 75-90%以上を占めるとされた 11。
方法
2022 年 9 月 20 日から 11 月 30 日までに関東地方の複数医療機関の発熱外来等を受診した 16 歳
以上の者(一部医療機関では成人)を対象に、検査前に基本属性、新型コロナワクチン接種歴
などを含む問診票に記載いただいた。意識障害のある者、直ちに治療が必要な者、日本語での
問診票に回答できない者には問診票の配布を行わなかった。のちに各医療機関で新型コロナウ
イルス感染症の診断目的に実施している核酸検査(PCR)の検査結果が判明した際に検査陽性者
を症例群(ケース)
、検査陰性者を対照群(コントロール)と分類した。発症から 14 日以内
で、37.5℃以上の発熱、全身倦怠感、寒気、関節痛、頭痛、鼻汁、咳嗽、咽頭痛、呼吸困難感、
嘔気・下痢・腹痛、嗅覚味覚障害のいずれか 1 症状のある者に限定して解析を行うこととし
た。また、期間中にすでに受診した記録のある者は本解析においては除外した。解析に際し
て、製造会社の区別はせず、mRNA ワクチン以外を一度でも接種された者、接種されたワクチ
ンの種類が一回でも不明であった者は除外した。
ワクチン接種歴については、(1)未接種、
(2)1 回接種または 2 回接種から 13 日以内、
(3)
2 回接種から 14 日-3 ヶ月(14-90 日)、
(4)2 回接種から 3-6 ヶ月(91-180 日)、(5)2 回接種
から 6 ヶ月以降(181 日以降)
、
(6)3 回接種から 13 日以内、(7)3 回接種から 14 日-3 ヶ月
1