よむ、つかう、まなぶ。
資料3-2 抗がんWG (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00025.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第53回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
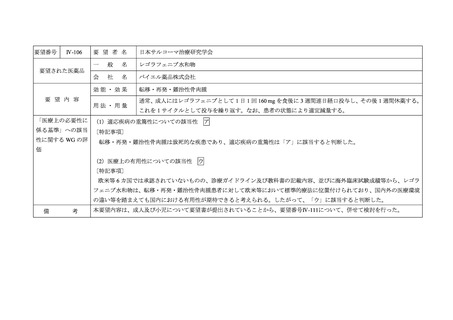
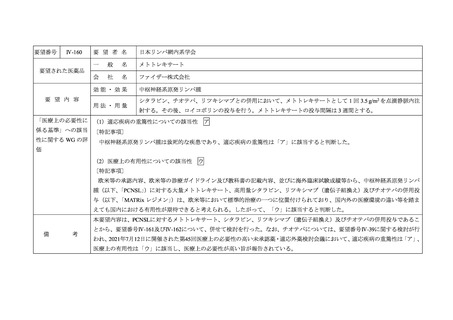
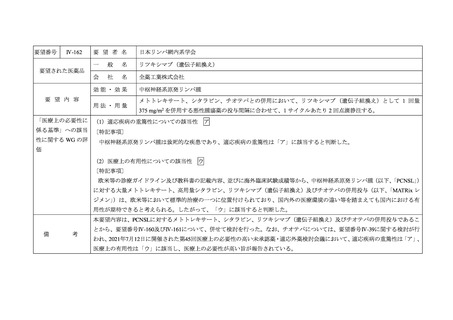
要望番号
Ⅳ-161
要 望 者 名
日本リンパ網内系学会
一
般
名
シタラビン
会
社
名
日本新薬株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
中枢神経系原発リンパ腫
メトトレキサート、チオテパ、リツキシマブとの併用において、シタラビンとして 1 回 2 g/m2 を 1 日 2 回、1 時
間かけて 2 日間(計 4 回)連日静脈内投与する。
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
ア
中枢神経系原発リンパ腫は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
価
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
欧米等の診療ガイドライン及び教科書の記載内容、並びに海外臨床試験成績等から、中枢神経系原発リンパ腫(以下、
「PCNSL」)
に対する大量メトトレキサート、高用量シタラビン、リツキシマブ(遺伝子組換え)及びチオテパの併用投与(以下、
「MATRix レ
ジメン」)は、欧米等において標準的治療の一つに位置付けられており、国内外の医療環境の違い等を踏まえても国内における有
用性が期待できると考えられる。したがって、「ウ」に該当すると判断した。
本要望内容は、PCNSLに対するメトトレキサート、シタラビン、リツキシマブ(遺伝子組換え)及びチオテパの併用投与であるこ
備
考
とから、要望番号Ⅳ-160及びⅣ-162について、併せて検討を行った。なお、チオテパについては、要望番号Ⅳ-39に関する検討が行
われ、2021年7月12日に開催された第45回医療上の必要性の高い未承認薬・適応外薬検討会議において、適応疾病の重篤性は「ア」、
医療上の有用性は「ウ」に該当し、医療上の必要性が高い旨が報告されている。
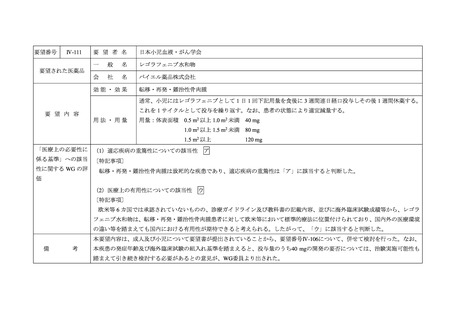
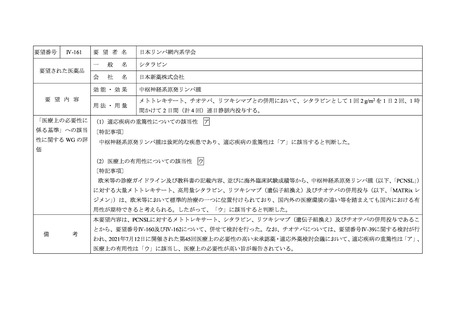
Ⅳ-161
要 望 者 名
日本リンパ網内系学会
一
般
名
シタラビン
会
社
名
日本新薬株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
中枢神経系原発リンパ腫
メトトレキサート、チオテパ、リツキシマブとの併用において、シタラビンとして 1 回 2 g/m2 を 1 日 2 回、1 時
間かけて 2 日間(計 4 回)連日静脈内投与する。
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
ア
中枢神経系原発リンパ腫は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
価
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
欧米等の診療ガイドライン及び教科書の記載内容、並びに海外臨床試験成績等から、中枢神経系原発リンパ腫(以下、
「PCNSL」)
に対する大量メトトレキサート、高用量シタラビン、リツキシマブ(遺伝子組換え)及びチオテパの併用投与(以下、
「MATRix レ
ジメン」)は、欧米等において標準的治療の一つに位置付けられており、国内外の医療環境の違い等を踏まえても国内における有
用性が期待できると考えられる。したがって、「ウ」に該当すると判断した。
本要望内容は、PCNSLに対するメトトレキサート、シタラビン、リツキシマブ(遺伝子組換え)及びチオテパの併用投与であるこ
備
考
とから、要望番号Ⅳ-160及びⅣ-162について、併せて検討を行った。なお、チオテパについては、要望番号Ⅳ-39に関する検討が行
われ、2021年7月12日に開催された第45回医療上の必要性の高い未承認薬・適応外薬検討会議において、適応疾病の重篤性は「ア」、
医療上の有用性は「ウ」に該当し、医療上の必要性が高い旨が報告されている。