よむ、つかう、まなぶ。
資料3-2 抗がんWG (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00025.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第53回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
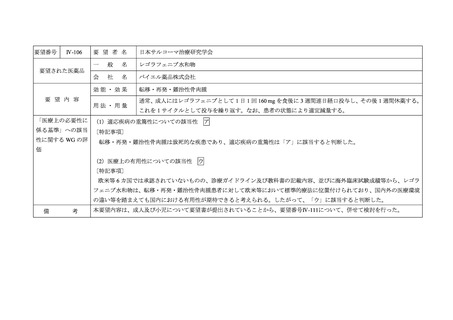
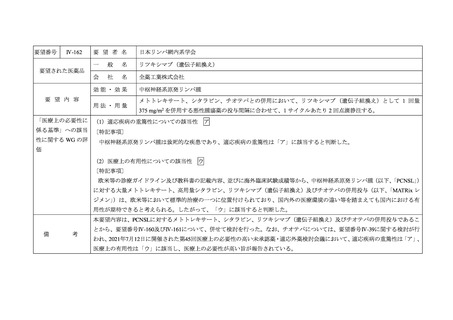
要望番号
Ⅳ-99
要 望 者 名
日本血液学会
一
般
名
Enasidenib
会
社
名
ブリストル・マイヤーズ スクイブ株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
再発又は難治性の IDH2 変異陽性の急性骨髄性白血病
通常 1 日 1 回・100 mg 経口投与
重篤な副作用を認めないかぎり、病勢の進行をみとめるまで継続投与
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
ア
再発又は難治性の IDH2 変異陽性の急性骨髄性白血病は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
価
(2)医療上の有用性についての該当性
エ
〔特記事項〕
以下の理由から、本要望については「ア」~「ウ」のいずれの基準にも該当しないことから、
「エ」に該当すると考える。
① 本邦においては、再発又は難治性の急性骨髄性白血病(以下、「AML」)に対しては、IDH2 遺伝子変異の有無にかかわらず、
アザシチジン(以下、「AZA」
)
、高用量又は中用量のシタラビン(以下、「Ara-C」)、MEC(ミトキサントロン、エトポシド及
び Ara-C の併用投与)、FLAG-IDA(フルダラビンリン酸エステル、イダルビシン塩酸塩、Ara-C 及び G-CSF 製剤の併用投与)
等の薬物療法が承認されていること。
② 再発又は難治性の IDH2 遺伝子変異陽性の AML 患者を対象とした海外第Ⅲ相試験(IDHENTIFY 試験)において、主要評価項
目とされた全生存期間について、対照(AZA、Ara-C 等の investigator’s choice)群に対する Enasidenib 群の優越性が検証されな
かったこと等を考慮すると、有効性・安全性等が既存の療法と比べて明らかに優れていることを示す成績は得られていないこ
と。
③ 欧米等の承認状況及び欧米等の診療ガイドラインの記載について、いずれの診療ガイドラインにおいても Enasidenib は再発又
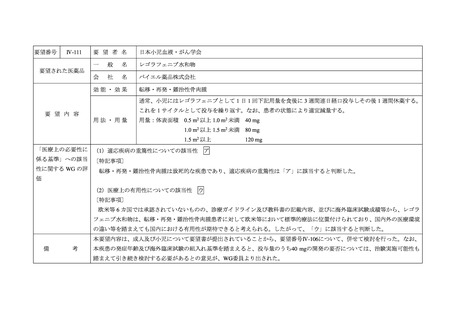
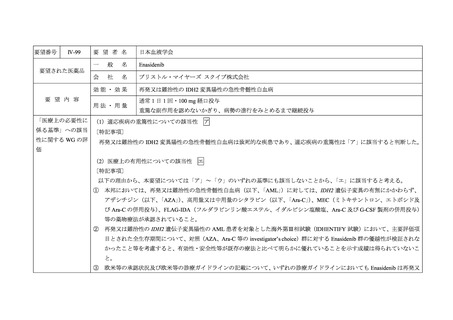
Ⅳ-99
要 望 者 名
日本血液学会
一
般
名
Enasidenib
会
社
名
ブリストル・マイヤーズ スクイブ株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
再発又は難治性の IDH2 変異陽性の急性骨髄性白血病
通常 1 日 1 回・100 mg 経口投与
重篤な副作用を認めないかぎり、病勢の進行をみとめるまで継続投与
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
ア
再発又は難治性の IDH2 変異陽性の急性骨髄性白血病は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
価
(2)医療上の有用性についての該当性
エ
〔特記事項〕
以下の理由から、本要望については「ア」~「ウ」のいずれの基準にも該当しないことから、
「エ」に該当すると考える。
① 本邦においては、再発又は難治性の急性骨髄性白血病(以下、「AML」)に対しては、IDH2 遺伝子変異の有無にかかわらず、
アザシチジン(以下、「AZA」
)
、高用量又は中用量のシタラビン(以下、「Ara-C」)、MEC(ミトキサントロン、エトポシド及
び Ara-C の併用投与)、FLAG-IDA(フルダラビンリン酸エステル、イダルビシン塩酸塩、Ara-C 及び G-CSF 製剤の併用投与)
等の薬物療法が承認されていること。
② 再発又は難治性の IDH2 遺伝子変異陽性の AML 患者を対象とした海外第Ⅲ相試験(IDHENTIFY 試験)において、主要評価項
目とされた全生存期間について、対照(AZA、Ara-C 等の investigator’s choice)群に対する Enasidenib 群の優越性が検証されな
かったこと等を考慮すると、有効性・安全性等が既存の療法と比べて明らかに優れていることを示す成績は得られていないこ
と。
③ 欧米等の承認状況及び欧米等の診療ガイドラインの記載について、いずれの診療ガイドラインにおいても Enasidenib は再発又