よむ、つかう、まなぶ。
資料4-2 企業から提出された開発工程表における進捗について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00025.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第53回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
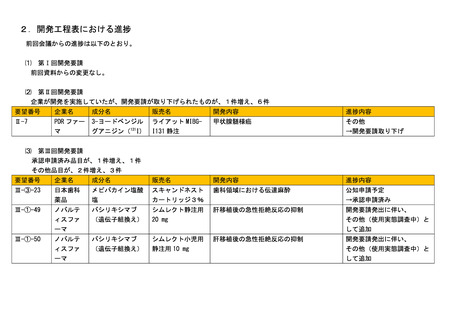
2.開発工程表における進捗
前回会議からの進捗は以下のとおり。
⑴ 第Ⅰ回開発要請
前回資料からの変更なし。
⑵
第Ⅱ回開発要請
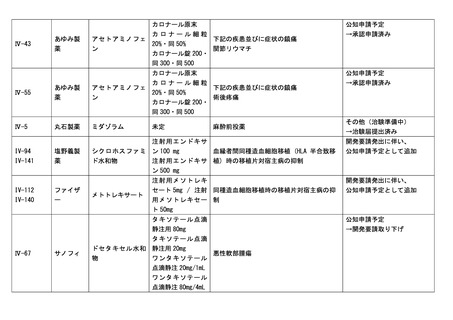
企業が開発を実施していたが、開発要請が取り下げられたものが、1件増え、6件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅱ-7
PDR ファー
マ
3-ヨードベンジル
グアニジン(131I)
ライアット MIBGI131 静注
甲状腺髄様癌
その他
→開発要請取り下げ
⑶
第Ⅲ回開発要請
承認申請済み品目が、1件増え、1件
その他品目が、2件増え、3件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅲ-③-23
日本歯科
薬品
メピバカイン塩酸
塩
スキャンドネスト
カートリッジ3%
歯科領域における伝達麻酔
公知申請予定
→承認申請済み
Ⅲ-①-49
ノバルテ
ィスファ
バシリキシマブ
(遺伝子組換え)
シムレクト静注用
20 mg
肝移植後の急性拒絶反応の抑制
開発要請発出に伴い、
その他(使用実態調査中)と
ーマ
Ⅲ-①-50
ノバルテ
ィスファ
ーマ
して追加
バシリキシマブ
(遺伝子組換え)
シムレクト小児用
静注用 10 mg
肝移植後の急性拒絶反応の抑制
開発要請発出に伴い、
その他(使用実態調査中)と
して追加
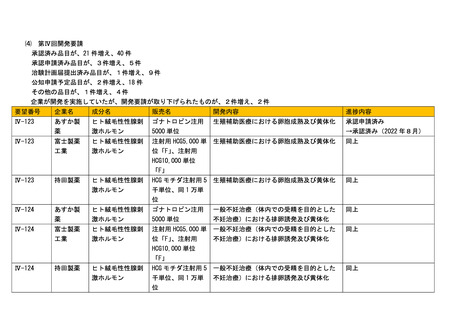
前回会議からの進捗は以下のとおり。
⑴ 第Ⅰ回開発要請
前回資料からの変更なし。
⑵
第Ⅱ回開発要請
企業が開発を実施していたが、開発要請が取り下げられたものが、1件増え、6件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅱ-7
PDR ファー
マ
3-ヨードベンジル
グアニジン(131I)
ライアット MIBGI131 静注
甲状腺髄様癌
その他
→開発要請取り下げ
⑶
第Ⅲ回開発要請
承認申請済み品目が、1件増え、1件
その他品目が、2件増え、3件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅲ-③-23
日本歯科
薬品
メピバカイン塩酸
塩
スキャンドネスト
カートリッジ3%
歯科領域における伝達麻酔
公知申請予定
→承認申請済み
Ⅲ-①-49
ノバルテ
ィスファ
バシリキシマブ
(遺伝子組換え)
シムレクト静注用
20 mg
肝移植後の急性拒絶反応の抑制
開発要請発出に伴い、
その他(使用実態調査中)と
ーマ
Ⅲ-①-50
ノバルテ
ィスファ
ーマ
して追加
バシリキシマブ
(遺伝子組換え)
シムレクト小児用
静注用 10 mg
肝移植後の急性拒絶反応の抑制
開発要請発出に伴い、
その他(使用実態調査中)と
して追加