よむ、つかう、まなぶ。
参考資料5:「人を対象とする生命科学・医学系研究に関する倫理指針」一部改正案(概要)に対するパブリック・コメント結果について(第8回生命科学・医学系研究等における個人情報の取扱い等に関する合同会議配付資料1及び参考資料4) (12 ページ)
出典
| 公開元URL | https://www.mext.go.jp/kaigisiryo/2022/mext_00058.html |
| 出典情報 | 科学技術・学術審議会 生命倫理・安全部会(第51回 2/8)《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
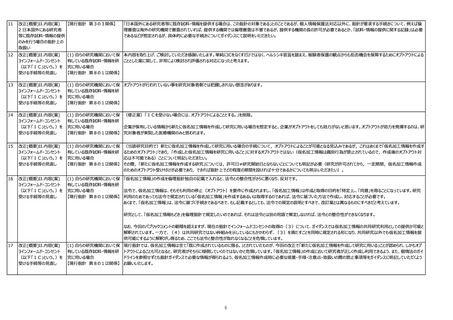
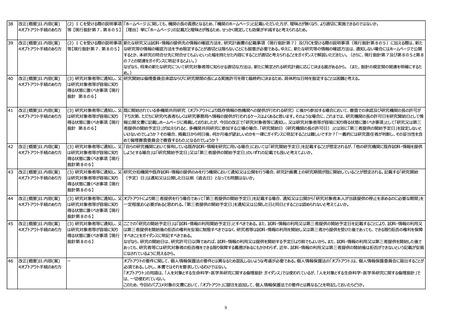
3
見直しの方向性について
(取りまとめ)
10頁
2.インフォームド・コンセントのあ
り方に係る論点
(2)既存試料・情報を自機
関利用、他機関提供する場合
における社会的重要性の要否
上項で記載されている【方向性】のなかで、
「ICを取得することが困難な場合であっても、可能な限り適切な同意を取得し、又はオプトアウトによる場合でも手紙やメール等で研究対象者等に通知するなどの特段の配慮の必要
性について、倫理審査委員会で十分な検討が必要である旨をガイダンスに記載すべき。」
との記載があります。
「手紙やメール等で研究対象者等に通知するなど」ですが、本議論はオプトアウトの方法についてですので、研究に関する連絡目的で事前に対象者から住所やメール等情報の提供は受
けていないはずです。
そうしますと本来患者が当該医療機関等で診療を受けるために提供した住所等の情報を、研究に関する連絡に用いることとなり、これは個人情報の適正利用の点から問題(目的外
利用)となる可能性を懸念します。
従いまして、例え既存の要配慮個人情報の他機関への提供においても、従来通り当該研究機関における情報公開(オプトアウト)での対応で可とするのが適切と考えます。
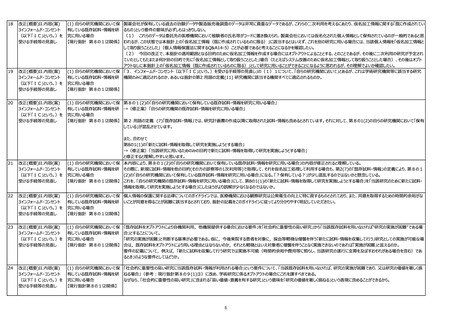
4
見直しの方向性について
(取りまとめ)
5
見直しの方向性について
(取りまとめ)
10頁
既存試料・情報を自機関利用、
他機関提供する場合における社
会的重要性の要否について
11頁
(3)簡略化規定のあり方
・診断薬の研究の多くが、既存試料・情報を自機関利用(病院)、他機関提供(企業)にあたると思うが、既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝
えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化していくと考えて問題ないか。
【方向性】
○現行の規定を以下の方向性で整理すべき。
・・・
マル2指針第8の1(3)ア(イ)・イ(イ)マル2:既存試料・情報の提供
マル3指針第8の1(5)イ(ウ):IC手続簡略化による提供を受ける場合
→既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化する。
とあるが、かつての地域がん登録における医療機関からがん登録機関への情報提供およびそれによって得られた情報を集計してなされる調査研究のように悉皆性が求められる場合もあ
るので、「既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化する」とするのは不適切であ
る(そもそも、「研究結果にバイアスが生じる可能性がある等の研究である場合」のみを想定し、マル1においては想定されている「悉皆性を求めるような研究である場合」について想定し
ていないのはおかしい)。
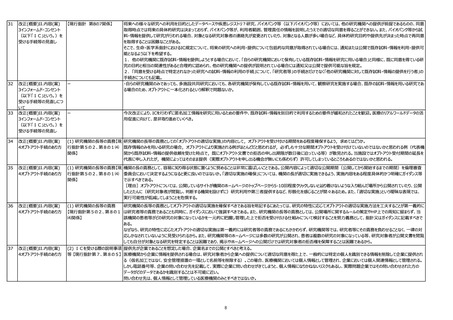
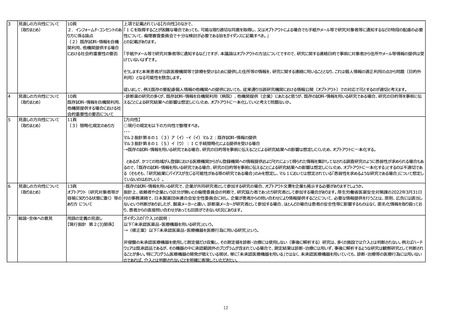
6
見直しの方向性について
(取りまとめ)
13頁
オプトアウト(研究対象者等が
容易に知りうる状態に置く)等の
あり方 について
・既存の試料・情報を用いる研究で、企業が共同研究者として参加する研究の場合、オプトアウト文書を企業も掲示する必要がありますでしょうか。
指針上、依頼者や企業という区分が無いとの倫理委員会の判断で、研究協力者であったり研究者として参加する場合があります。厚生労働省医薬安全対策課の2022年3月31日
付の事務連絡で、日本製薬団体連合会安全性委員会に対し、企業が患者からの問い合わせにより情報提供することについて、必要な情報提供を行うことは、原則、広告には該当し
ないという判断がありましたが、製薬メーカーと違い、診断薬メーカーが研究者として参加する場合、ほとんどの場合は患者の安全性等に影響するものはなく、匿名化情報を取り扱ってお
り、患者からの直接問い合わせがあっても回答ができない状況にあります。
7
総論・全体への意見
用語の定義の見直し
【現行指針 第2(3)関係】
ガイダンスの「介入」の説明:
以下「未承認医薬品・医療機器を用いる研究」という。
→(修正案)以下「未承認医薬品・医療機器を医療行為に用いる研究」という。
非侵襲の未承認医療機器を使用して測定値だけ収集し、その測定値を診断・治療には使用しない(事後に解析する)研究は、多くの施設では介入とは判断されない。例えばハード
ウェアは既承認品であるが、その機器の中に承認範囲外のプログラムが含まれている場合で、測定結果は診断・治療には用いず、事後に解析するような研究は観察研究として判断され
ることが多い。特にプログラム医療機器の開発が増えている現状、単に「未承認医療機器を用いる」ではなく、未承認医療機器を用いていても、診断・治療等の医療行為には用いない
のであれば、介入とは判断されないことを明確に表現していただきたい。
12
見直しの方向性について
(取りまとめ)
10頁
2.インフォームド・コンセントのあ
り方に係る論点
(2)既存試料・情報を自機
関利用、他機関提供する場合
における社会的重要性の要否
上項で記載されている【方向性】のなかで、
「ICを取得することが困難な場合であっても、可能な限り適切な同意を取得し、又はオプトアウトによる場合でも手紙やメール等で研究対象者等に通知するなどの特段の配慮の必要
性について、倫理審査委員会で十分な検討が必要である旨をガイダンスに記載すべき。」
との記載があります。
「手紙やメール等で研究対象者等に通知するなど」ですが、本議論はオプトアウトの方法についてですので、研究に関する連絡目的で事前に対象者から住所やメール等情報の提供は受
けていないはずです。
そうしますと本来患者が当該医療機関等で診療を受けるために提供した住所等の情報を、研究に関する連絡に用いることとなり、これは個人情報の適正利用の点から問題(目的外
利用)となる可能性を懸念します。
従いまして、例え既存の要配慮個人情報の他機関への提供においても、従来通り当該研究機関における情報公開(オプトアウト)での対応で可とするのが適切と考えます。
4
見直しの方向性について
(取りまとめ)
5
見直しの方向性について
(取りまとめ)
10頁
既存試料・情報を自機関利用、
他機関提供する場合における社
会的重要性の要否について
11頁
(3)簡略化規定のあり方
・診断薬の研究の多くが、既存試料・情報を自機関利用(病院)、他機関提供(企業)にあたると思うが、既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝
えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化していくと考えて問題ないか。
【方向性】
○現行の規定を以下の方向性で整理すべき。
・・・
マル2指針第8の1(3)ア(イ)・イ(イ)マル2:既存試料・情報の提供
マル3指針第8の1(5)イ(ウ):IC手続簡略化による提供を受ける場合
→既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化する。
とあるが、かつての地域がん登録における医療機関からがん登録機関への情報提供およびそれによって得られた情報を集計してなされる調査研究のように悉皆性が求められる場合もあ
るので、「既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化する」とするのは不適切であ
る(そもそも、「研究結果にバイアスが生じる可能性がある等の研究である場合」のみを想定し、マル1においては想定されている「悉皆性を求めるような研究である場合」について想定し
ていないのはおかしい)。
6
見直しの方向性について
(取りまとめ)
13頁
オプトアウト(研究対象者等が
容易に知りうる状態に置く)等の
あり方 について
・既存の試料・情報を用いる研究で、企業が共同研究者として参加する研究の場合、オプトアウト文書を企業も掲示する必要がありますでしょうか。
指針上、依頼者や企業という区分が無いとの倫理委員会の判断で、研究協力者であったり研究者として参加する場合があります。厚生労働省医薬安全対策課の2022年3月31日
付の事務連絡で、日本製薬団体連合会安全性委員会に対し、企業が患者からの問い合わせにより情報提供することについて、必要な情報提供を行うことは、原則、広告には該当し
ないという判断がありましたが、製薬メーカーと違い、診断薬メーカーが研究者として参加する場合、ほとんどの場合は患者の安全性等に影響するものはなく、匿名化情報を取り扱ってお
り、患者からの直接問い合わせがあっても回答ができない状況にあります。
7
総論・全体への意見
用語の定義の見直し
【現行指針 第2(3)関係】
ガイダンスの「介入」の説明:
以下「未承認医薬品・医療機器を用いる研究」という。
→(修正案)以下「未承認医薬品・医療機器を医療行為に用いる研究」という。
非侵襲の未承認医療機器を使用して測定値だけ収集し、その測定値を診断・治療には使用しない(事後に解析する)研究は、多くの施設では介入とは判断されない。例えばハード
ウェアは既承認品であるが、その機器の中に承認範囲外のプログラムが含まれている場合で、測定結果は診断・治療には用いず、事後に解析するような研究は観察研究として判断され
ることが多い。特にプログラム医療機器の開発が増えている現状、単に「未承認医療機器を用いる」ではなく、未承認医療機器を用いていても、診断・治療等の医療行為には用いない
のであれば、介入とは判断されないことを明確に表現していただきたい。
12