よむ、つかう、まなぶ。
参考資料5:「人を対象とする生命科学・医学系研究に関する倫理指針」一部改正案(概要)に対するパブリック・コメント結果について(第8回生命科学・医学系研究等における個人情報の取扱い等に関する合同会議配付資料1及び参考資料4) (13 ページ)
出典
| 公開元URL | https://www.mext.go.jp/kaigisiryo/2022/mext_00058.html |
| 出典情報 | 科学技術・学術審議会 生命倫理・安全部会(第51回 2/8)《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
8
総論・全体への意見
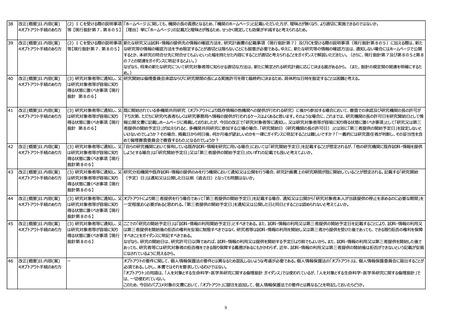
用語の定義の見直し
【現行指針 第2(6)関係】
(6) 試料・情報:試料及び研究に用いられる情報をいう。
→(修正案)試料及び/又は研究に用いられる情報をいう。
元々「試料・情報」は血液のように試料があるものから得られる情報(試料と情報が元々セットになっているイメージ)であり、心電図波形のような試料が存在しない情報のみのものは
「試料・情報」には該当しないという考え方だったと記憶しています。しかしながらそれだと「第8 インフォームド・コンセントを受ける手続等」から外れてしまうため、試料がない情報についても
試料・情報と同様に考えてくださいという説明がありましたが、分かりにくいです。定義語を修正するか、「第8 インフォームド・コンセントを受ける手続等」で使用される言葉を、「新たに試
料・情報を取得して研究を実施しようとする場合」→「新たに試料及び/又は情報を取得して研究を実施しようとする場合」というように修正するのが適切ではないでしょうか。
9
総論・全体への意見
10
総論・全体への意見
11
総論・全体への意見
12
総論・全体への意見
13
総論・全体への意見
14
総論・全体への意見
15
総論・全体への意見
16
総論・全体への意見
17
総論・全体への意見
18
総論・全体への意見
19
全体への意見
【現行指針 第2(7)・第8の1関 既存試料について、指針ガイダンスにおいて、第2の「(7)既存試料・情報」の解説では『この指針にいう「既存試料・情報」は、研究計画書作成以降対象者から取得される試料・
係】
情報も含まれ得ることに留意すること。』との記載がある一方、第8の1「(1)新たに試料・情報を取得して研究を実施しようとする場合」の解説では、『他方、研究対象者から試料・
情報取得を実施しようとする時点において、既に研究で利用する目的がある場合においては、医療のための対象者からの試料・情報取得を兼ねている場合であっても「新たに試料・情
報を取得して実施しようとする場合」に該当する」とあり、双方の解説に矛盾があるようにも受け取れる。第2の(7)が前提で、第8の1の解説は、医療で必要とする試料・情報の提
供に加えて、研究のために追加がある場合という理解でよいか。
【現行指針 第2(15)関係】
〇「学術研究機関等」の範囲について
・厚生労働省は医師偏在対策を重要施策の一つとして実施しており、今後ますます一般病院と大学機関を移動しながら学術研究を行う医師(医学研究者)が増えることが想定され
る。一般病院での研究について、公衆衛生例外を適用してオプトアウトを認める方向性がガイダンスで示されたものの、公衆衛生例外の適用には同意取得困難要件がかかるため、一般
病院に勤務する医学研究者の研究ハードルは上がっており、我が国の研究力低下が懸念される。従って学術研究機関等の範囲は以前のように広げるべきではないか。
用語の定義の見直し
「臨床研究」という用語を定義していただきたい。
【現行指針 第2関係】
臨床研究法との差に非常に混乱している。「臨床研究」は臨床研究法の定義に統一するのであれば、法以外の研究は、「臨床研究」とは呼ばず「人を対象とする生命科学・医学系研
究」と呼ぶなど、明記してはいかがか?
【現行指針 第8の1関係】
「特段の理由がある場合であって、研究対象者等からインフォームド・コンセント及び適切な同意を受けることが困難である」場合について、ガイダンスにおいては、個人情報保護法第18
条第3項第3号の解釈として「個人情報の保護に関する法律についてのガイドライン」に関するQ2の15およびQ7の24の医療機関等が利用する場合のみが例示されているが、
医学、薬学等の発展や医療水準の向上に寄与する研究の推進のため、Q2の14およびQ7の25についても参照していただきたい。
【現行指針 第8の1(1)関係】 令和4年6月6日改訂の指針ガイダンスより、第8 1 (1) の解説として p.77 1 部分に「他方、研究対象者から試料・情報を取得する時点において、既に研究で利用する目的が
ある場合においては、医療のための研究対象者からの試料・情報の取得を兼ねている場合であっても「新たに試料・情報を取得して研究を実施しようとする場合」に該当する。」との一文
が追加されましたが、さりげなさ過ぎて周知されていないと存じます。第2 (7) 既存試料・情報 の解説部分にも追記しもう少し詳しい解説(診療上必要があって取得する情報であって
も既存情報とは別の取扱いが必要である旨)を加えていただくなど、認知度が高まるようご対応をお願いいたします。
【現行指針 第8の1(2)関係】 本改正案では、新たに作成する仮名加工情報について「ICを受けない場合はオプトアウトによること」とされているが、オプトアウトも不要とし、個人情報保護法の上乗せとなっている現状
を解消すべき。
【現行指針 第8の1(3)ア関係】 試料を用いない研究において、要配慮個人情報のみを新たに取得し共同研究機関と共有する場合は、個人情報保護法上の同意(適切な同意)が認められている。一方、既存情
報を他の研究機関に提供する場合はICが求められている。この場合においても試料を用いず要配慮個人情報のみを取り扱う際には、ICではなく個人情報保護法上の同意(適切な
同意)が認められるべき。
【現行指針 第8の5⑪関係】
本改正案では、仮名加工情報への加工が想定されていなかった情報を新たに加工する場合に事前のIC無しにオプトアウトによる手続を認めることとされている。そうであれば、取得当初
から仮名加工を予定している場合もICの説明事項に含めるべきではないため、ICにおける説明ではなく研究計画書への記載をもって代替可能とすべき。
【現行指針 第8の7関係】
「同意を受ける時点で特定されなかった研究への試料・情報の利用の手続」について、他機関へ試料・情報を提供する際、既に同意を得ている研究目的と相当の関連性があると合理
的に認められる場合には、オプトアウトによる手続きを認める旨を規定すべき。
総論・全体への意見
前回の改正の際に導入された「仮名加工情報」が、旧ヒトゲノム・遺伝子解析研究に関する倫理指針において安全管理措置として実施することが推奨されていた「匿名化(特定の個
人(死者を含む。以下同じ。)を識別することができることとなる記述等(個人識別符号を含む。)の全部又は一部を削除すること(当該記述等の全部又は一部を当該個人と関わ
りのない記述等に置き換えることを含む。))」という文言の削除と同時に記載され始めたことで、「仮名加工情報」=「匿名化した情報」と誤認されるケースが散見される。異なる概念で
ある旨を、研究者が分かりやすい形で定義の中に記載いただくことを強く希望する。また、これまで共同研究は共同利用ではない、という整理で指針が規定されていたが、どういった場合に
共同利用が可能であるか(一体のものとして取り扱うことに合理性があるとはどういうことか)、共同利用の場合の義務や留意すべきことなど整理してわかりやすく示す必要があると考えら
れる(現在もガイダンスにある程度記載されているが、難解で、解読できていないと考えられる研究者が多数存在する)。
総論・全体への意見
IC取得方法の容易な理解のため、以下を提案する。
1. ICの定義に「文書によるものを原則とするが、口頭+記録も認める」あるいは「文書および口頭+記録のいずれかの方法による」との記載を追記し、指針文書や説明用フロー
チャートの記載を「文書と口頭+記録」の併記・説明から「IC」に統一する。この点を修正すれば、内容を変更せずに全体が整理されると考える。
2.介入研究に関連した項目にのみ、文書ICのみを求めていることを追記する。
13
総論・全体への意見
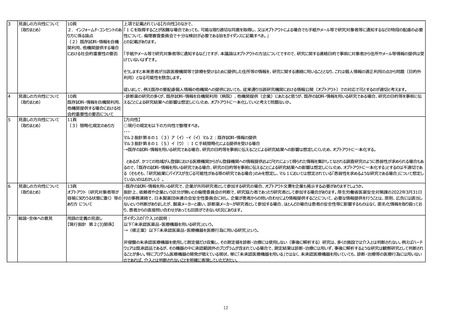
用語の定義の見直し
【現行指針 第2(6)関係】
(6) 試料・情報:試料及び研究に用いられる情報をいう。
→(修正案)試料及び/又は研究に用いられる情報をいう。
元々「試料・情報」は血液のように試料があるものから得られる情報(試料と情報が元々セットになっているイメージ)であり、心電図波形のような試料が存在しない情報のみのものは
「試料・情報」には該当しないという考え方だったと記憶しています。しかしながらそれだと「第8 インフォームド・コンセントを受ける手続等」から外れてしまうため、試料がない情報についても
試料・情報と同様に考えてくださいという説明がありましたが、分かりにくいです。定義語を修正するか、「第8 インフォームド・コンセントを受ける手続等」で使用される言葉を、「新たに試
料・情報を取得して研究を実施しようとする場合」→「新たに試料及び/又は情報を取得して研究を実施しようとする場合」というように修正するのが適切ではないでしょうか。
9
総論・全体への意見
10
総論・全体への意見
11
総論・全体への意見
12
総論・全体への意見
13
総論・全体への意見
14
総論・全体への意見
15
総論・全体への意見
16
総論・全体への意見
17
総論・全体への意見
18
総論・全体への意見
19
全体への意見
【現行指針 第2(7)・第8の1関 既存試料について、指針ガイダンスにおいて、第2の「(7)既存試料・情報」の解説では『この指針にいう「既存試料・情報」は、研究計画書作成以降対象者から取得される試料・
係】
情報も含まれ得ることに留意すること。』との記載がある一方、第8の1「(1)新たに試料・情報を取得して研究を実施しようとする場合」の解説では、『他方、研究対象者から試料・
情報取得を実施しようとする時点において、既に研究で利用する目的がある場合においては、医療のための対象者からの試料・情報取得を兼ねている場合であっても「新たに試料・情
報を取得して実施しようとする場合」に該当する」とあり、双方の解説に矛盾があるようにも受け取れる。第2の(7)が前提で、第8の1の解説は、医療で必要とする試料・情報の提
供に加えて、研究のために追加がある場合という理解でよいか。
【現行指針 第2(15)関係】
〇「学術研究機関等」の範囲について
・厚生労働省は医師偏在対策を重要施策の一つとして実施しており、今後ますます一般病院と大学機関を移動しながら学術研究を行う医師(医学研究者)が増えることが想定され
る。一般病院での研究について、公衆衛生例外を適用してオプトアウトを認める方向性がガイダンスで示されたものの、公衆衛生例外の適用には同意取得困難要件がかかるため、一般
病院に勤務する医学研究者の研究ハードルは上がっており、我が国の研究力低下が懸念される。従って学術研究機関等の範囲は以前のように広げるべきではないか。
用語の定義の見直し
「臨床研究」という用語を定義していただきたい。
【現行指針 第2関係】
臨床研究法との差に非常に混乱している。「臨床研究」は臨床研究法の定義に統一するのであれば、法以外の研究は、「臨床研究」とは呼ばず「人を対象とする生命科学・医学系研
究」と呼ぶなど、明記してはいかがか?
【現行指針 第8の1関係】
「特段の理由がある場合であって、研究対象者等からインフォームド・コンセント及び適切な同意を受けることが困難である」場合について、ガイダンスにおいては、個人情報保護法第18
条第3項第3号の解釈として「個人情報の保護に関する法律についてのガイドライン」に関するQ2の15およびQ7の24の医療機関等が利用する場合のみが例示されているが、
医学、薬学等の発展や医療水準の向上に寄与する研究の推進のため、Q2の14およびQ7の25についても参照していただきたい。
【現行指針 第8の1(1)関係】 令和4年6月6日改訂の指針ガイダンスより、第8 1 (1) の解説として p.77 1 部分に「他方、研究対象者から試料・情報を取得する時点において、既に研究で利用する目的が
ある場合においては、医療のための研究対象者からの試料・情報の取得を兼ねている場合であっても「新たに試料・情報を取得して研究を実施しようとする場合」に該当する。」との一文
が追加されましたが、さりげなさ過ぎて周知されていないと存じます。第2 (7) 既存試料・情報 の解説部分にも追記しもう少し詳しい解説(診療上必要があって取得する情報であって
も既存情報とは別の取扱いが必要である旨)を加えていただくなど、認知度が高まるようご対応をお願いいたします。
【現行指針 第8の1(2)関係】 本改正案では、新たに作成する仮名加工情報について「ICを受けない場合はオプトアウトによること」とされているが、オプトアウトも不要とし、個人情報保護法の上乗せとなっている現状
を解消すべき。
【現行指針 第8の1(3)ア関係】 試料を用いない研究において、要配慮個人情報のみを新たに取得し共同研究機関と共有する場合は、個人情報保護法上の同意(適切な同意)が認められている。一方、既存情
報を他の研究機関に提供する場合はICが求められている。この場合においても試料を用いず要配慮個人情報のみを取り扱う際には、ICではなく個人情報保護法上の同意(適切な
同意)が認められるべき。
【現行指針 第8の5⑪関係】
本改正案では、仮名加工情報への加工が想定されていなかった情報を新たに加工する場合に事前のIC無しにオプトアウトによる手続を認めることとされている。そうであれば、取得当初
から仮名加工を予定している場合もICの説明事項に含めるべきではないため、ICにおける説明ではなく研究計画書への記載をもって代替可能とすべき。
【現行指針 第8の7関係】
「同意を受ける時点で特定されなかった研究への試料・情報の利用の手続」について、他機関へ試料・情報を提供する際、既に同意を得ている研究目的と相当の関連性があると合理
的に認められる場合には、オプトアウトによる手続きを認める旨を規定すべき。
総論・全体への意見
前回の改正の際に導入された「仮名加工情報」が、旧ヒトゲノム・遺伝子解析研究に関する倫理指針において安全管理措置として実施することが推奨されていた「匿名化(特定の個
人(死者を含む。以下同じ。)を識別することができることとなる記述等(個人識別符号を含む。)の全部又は一部を削除すること(当該記述等の全部又は一部を当該個人と関わ
りのない記述等に置き換えることを含む。))」という文言の削除と同時に記載され始めたことで、「仮名加工情報」=「匿名化した情報」と誤認されるケースが散見される。異なる概念で
ある旨を、研究者が分かりやすい形で定義の中に記載いただくことを強く希望する。また、これまで共同研究は共同利用ではない、という整理で指針が規定されていたが、どういった場合に
共同利用が可能であるか(一体のものとして取り扱うことに合理性があるとはどういうことか)、共同利用の場合の義務や留意すべきことなど整理してわかりやすく示す必要があると考えら
れる(現在もガイダンスにある程度記載されているが、難解で、解読できていないと考えられる研究者が多数存在する)。
総論・全体への意見
IC取得方法の容易な理解のため、以下を提案する。
1. ICの定義に「文書によるものを原則とするが、口頭+記録も認める」あるいは「文書および口頭+記録のいずれかの方法による」との記載を追記し、指針文書や説明用フロー
チャートの記載を「文書と口頭+記録」の併記・説明から「IC」に統一する。この点を修正すれば、内容を変更せずに全体が整理されると考える。
2.介入研究に関連した項目にのみ、文書ICのみを求めていることを追記する。
13