よむ、つかう、まなぶ。
参考資料5:「人を対象とする生命科学・医学系研究に関する倫理指針」一部改正案(概要)に対するパブリック・コメント結果について(第8回生命科学・医学系研究等における個人情報の取扱い等に関する合同会議配付資料1及び参考資料4) (9 ページ)
出典
| 公開元URL | https://www.mext.go.jp/kaigisiryo/2022/mext_00058.html |
| 出典情報 | 科学技術・学術審議会 生命倫理・安全部会(第51回 2/8)《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
38
改正(概要)II.内容(案)
4オプトアウト手続のあり方
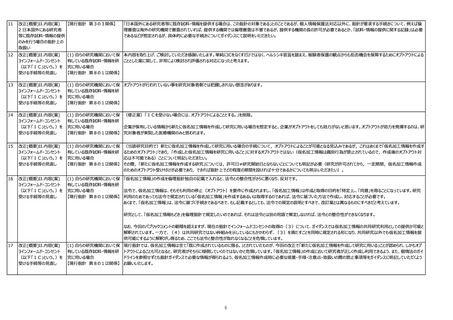
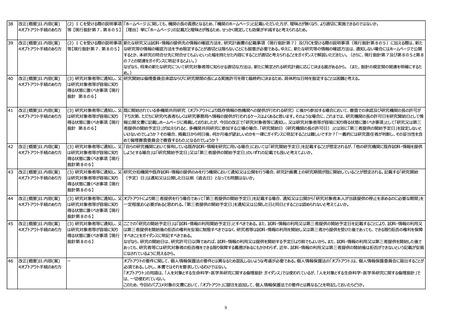
(2) ICを受ける際の説明事項 「ホームページ」に関しても、機関の長の責務となるため、「機関のホームページ」と記載いただいた方が、曖昧さが無くなり、より適切に実施できるのではないか。
等 【現行指針第7、第8の5】 [理由]単に「ホームページ」の記載だと曖昧さが残るため、せっかく規定しても効果が半減すると考えられるため。
39
改正(概要)II.内容(案)
4オプトアウト手続のあり方
40
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(2) ICを受ける際の説明事項 新たな研究又は試料・情報の提供先の情報の確認方法を、研究計画書の記載事項(現行指針第7)及びICを受ける際の説明事項(現行指針第8の5)に加える際は、新た
等【現行指針第7、第8の5】 な研究等の情報の確認方法を予め限定することが適切とは限らないことにも留意が必要である。ゆえに、新たな研究等の情報の確認方法は、通知しない場合にはホームページで公開
するとか、本研究の問合せ先に問合せてもよいといった幅を持たせた内容にすることが適切と考えられることをガイダンスで解説いただきたい。(さらに、現行指針第7及び第8の5と第8
の7との関連をガイダンスに明記するとよい。)
なぜなら、将来の新たな研究について研究対象者等に知らせる適切な方法は、新たに策定される研究計画に応じて決まる面があるから。(また、指針の規定間の関連を明確にするた
め。)
(3) 研究対象者等に通知し、又 研究開始は倫理委員会承認ならびに研究期間の長による実施許可を得て最終的に決まるため、具体的な日時を指定することは困難と考える。
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針 第8の6】
41
改正(概要)II.内容(案)
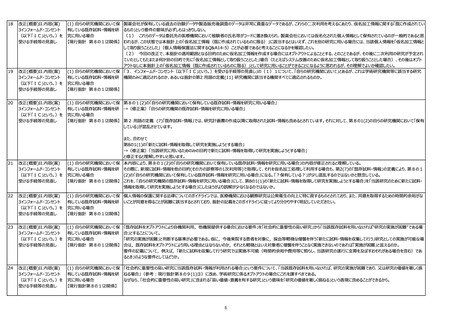
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針 第8の6】
42
改正(概要)II.内容(案)
4オプトアウト手続のあり方
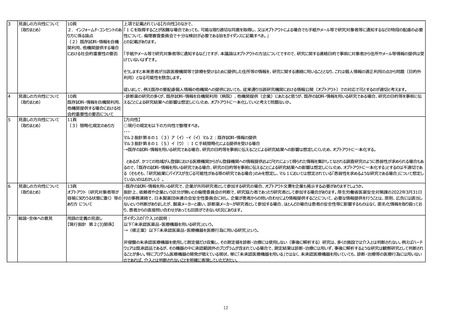
(3) 研究対象者等に通知し、又 「自らの研究機関において保有している既存試料・情報を研究に用いる場合」においては「研究開始予定日」を記載することが想定されるが、「他の研究機関に既存試料・情報を提供
は研究対象者等が容易に知り しようとする場合」は「研究開始予定日」又は「第三者提供の開始予定日」のいずれの記載でも良いと考えてよいか。
得る状態に置くべき事項 【現行
指針第8の6】
43
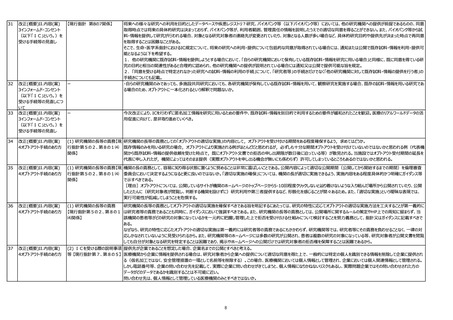
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又 研究分担機関や既存試料・情報の提供のみを行う機関において通知又は公開を行う場合、研究計画書上の研究期間が既に開始していることが想定される。記載する「研究開始
は研究対象者等が容易に知り (予定)日」は通知又は公開した日以前(過去日)となっても問題はないか。
得る状態に置くべき事項 【現行
指針第8の6】
44
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又 オプトアウトにより第三者提供を行う場合であって「第三者提供の開始予定日」を記載する場合、通知又は公開から「研究対象者本人が当該提供の停止を求めるのに必要な期間」を
は研究対象者等が容易に知り 一定程度おく必要があると思われる。「第三者提供の開始予定日」を通知又は公開した日と同日とすることは認められないと考えてよいか。
得る状態に置くべき事項 【現行
指針第8の6】
45
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針第8の6】
ここでの「研究の開始予定日」は「試料・情報の利用開始予定日」とすべきである。また、試料・情報の利用又は第三者提供の開始予定日を記載することにより、試料・情報の利用又
は第三者提供を開始後の拒否の権利を安易に制限すべきではなく、研究者等は試料・情報の利用を開始し又は第三者から提供を受けた後であっても、できる限り拒否の権利を保障
すべきことをガイダンスに明記すべきである。
なぜなら、研究の開始日は、研究許可日以降であれば、試料・情報の利用又は提供を開始する予定日より前でもよいから。また、試料・情報の利用又は第三者提供を開始した後で
あっても、研究者等には研究対象者の拒否権をできる限り保障する義務があるにもかかわらず、近年、試料・情報の利用又は第三者提供の開始後は拒否ができないという記載が安易
になされているように見えるから。
46
改正(概要)II.内容(案)
4オプトアウト手続のあり方
ー
オプトアウトの要件に関して、個人情報保護法の要件とは異なるため混乱しないような考慮が必要である。個人情報保護法の「オプトアウト」は、個人情報保護委員会に届出することが
必須である。しかし、本書ではそれを要求しているわけではない。
「オプトアウト」の用語は、「人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス」では使われているが、「人を対象とする生命科学・医学系研究に関する倫理指針」で
は、一切使われていない。
このため、今回のパブコメ対象の文書において、「オプトアウト」に脚注を追加して、個人情報保護法での要件とは異なることを明記しておいたらどうか。
既に開始されている多機関共同研究(オプトアウトにより既存情報の他機関への提供が行われる研究)に後から参加する場合において、審査での承認及び研究機関の長の許可が
下り次第、ただちに研究代表者もしくは研究事務局へ情報の提供が行われるケースはよくあると思います。そのような場合に、これまでは、研究機関の長の許可日を研究開始日として情
報公開文書に記載しホームページに掲載しておりましたが、今回の改正で「研究対象者等に通知し、又は研究対象者等が容易に知り得る状態に置くべき事項」として「研究又は第三
者提供の開始予定日」が加えられると、多機関共同研究に参加する立場の場合、「研究開始日(研究機関の長の許可日)」とは別に「第三者提供の開始予定日」を設定しないと
いけないのでしょうか?その場合、掲載日から何日後、何か月後が望ましいのかを一律にガイダンスに明記することは難しいですか?「一義的には研究責任者が判断し、その妥当性を含
めて倫理審査委員会で審査するもの」となるのでしょうか?
9
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(2) ICを受ける際の説明事項 「ホームページ」に関しても、機関の長の責務となるため、「機関のホームページ」と記載いただいた方が、曖昧さが無くなり、より適切に実施できるのではないか。
等 【現行指針第7、第8の5】 [理由]単に「ホームページ」の記載だと曖昧さが残るため、せっかく規定しても効果が半減すると考えられるため。
39
改正(概要)II.内容(案)
4オプトアウト手続のあり方
40
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(2) ICを受ける際の説明事項 新たな研究又は試料・情報の提供先の情報の確認方法を、研究計画書の記載事項(現行指針第7)及びICを受ける際の説明事項(現行指針第8の5)に加える際は、新た
等【現行指針第7、第8の5】 な研究等の情報の確認方法を予め限定することが適切とは限らないことにも留意が必要である。ゆえに、新たな研究等の情報の確認方法は、通知しない場合にはホームページで公開
するとか、本研究の問合せ先に問合せてもよいといった幅を持たせた内容にすることが適切と考えられることをガイダンスで解説いただきたい。(さらに、現行指針第7及び第8の5と第8
の7との関連をガイダンスに明記するとよい。)
なぜなら、将来の新たな研究について研究対象者等に知らせる適切な方法は、新たに策定される研究計画に応じて決まる面があるから。(また、指針の規定間の関連を明確にするた
め。)
(3) 研究対象者等に通知し、又 研究開始は倫理委員会承認ならびに研究期間の長による実施許可を得て最終的に決まるため、具体的な日時を指定することは困難と考える。
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針 第8の6】
41
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針 第8の6】
42
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又 「自らの研究機関において保有している既存試料・情報を研究に用いる場合」においては「研究開始予定日」を記載することが想定されるが、「他の研究機関に既存試料・情報を提供
は研究対象者等が容易に知り しようとする場合」は「研究開始予定日」又は「第三者提供の開始予定日」のいずれの記載でも良いと考えてよいか。
得る状態に置くべき事項 【現行
指針第8の6】
43
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又 研究分担機関や既存試料・情報の提供のみを行う機関において通知又は公開を行う場合、研究計画書上の研究期間が既に開始していることが想定される。記載する「研究開始
は研究対象者等が容易に知り (予定)日」は通知又は公開した日以前(過去日)となっても問題はないか。
得る状態に置くべき事項 【現行
指針第8の6】
44
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又 オプトアウトにより第三者提供を行う場合であって「第三者提供の開始予定日」を記載する場合、通知又は公開から「研究対象者本人が当該提供の停止を求めるのに必要な期間」を
は研究対象者等が容易に知り 一定程度おく必要があると思われる。「第三者提供の開始予定日」を通知又は公開した日と同日とすることは認められないと考えてよいか。
得る状態に置くべき事項 【現行
指針第8の6】
45
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(3) 研究対象者等に通知し、又
は研究対象者等が容易に知り
得る状態に置くべき事項 【現行
指針第8の6】
ここでの「研究の開始予定日」は「試料・情報の利用開始予定日」とすべきである。また、試料・情報の利用又は第三者提供の開始予定日を記載することにより、試料・情報の利用又
は第三者提供を開始後の拒否の権利を安易に制限すべきではなく、研究者等は試料・情報の利用を開始し又は第三者から提供を受けた後であっても、できる限り拒否の権利を保障
すべきことをガイダンスに明記すべきである。
なぜなら、研究の開始日は、研究許可日以降であれば、試料・情報の利用又は提供を開始する予定日より前でもよいから。また、試料・情報の利用又は第三者提供を開始した後で
あっても、研究者等には研究対象者の拒否権をできる限り保障する義務があるにもかかわらず、近年、試料・情報の利用又は第三者提供の開始後は拒否ができないという記載が安易
になされているように見えるから。
46
改正(概要)II.内容(案)
4オプトアウト手続のあり方
ー
オプトアウトの要件に関して、個人情報保護法の要件とは異なるため混乱しないような考慮が必要である。個人情報保護法の「オプトアウト」は、個人情報保護委員会に届出することが
必須である。しかし、本書ではそれを要求しているわけではない。
「オプトアウト」の用語は、「人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス」では使われているが、「人を対象とする生命科学・医学系研究に関する倫理指針」で
は、一切使われていない。
このため、今回のパブコメ対象の文書において、「オプトアウト」に脚注を追加して、個人情報保護法での要件とは異なることを明記しておいたらどうか。
既に開始されている多機関共同研究(オプトアウトにより既存情報の他機関への提供が行われる研究)に後から参加する場合において、審査での承認及び研究機関の長の許可が
下り次第、ただちに研究代表者もしくは研究事務局へ情報の提供が行われるケースはよくあると思います。そのような場合に、これまでは、研究機関の長の許可日を研究開始日として情
報公開文書に記載しホームページに掲載しておりましたが、今回の改正で「研究対象者等に通知し、又は研究対象者等が容易に知り得る状態に置くべき事項」として「研究又は第三
者提供の開始予定日」が加えられると、多機関共同研究に参加する立場の場合、「研究開始日(研究機関の長の許可日)」とは別に「第三者提供の開始予定日」を設定しないと
いけないのでしょうか?その場合、掲載日から何日後、何か月後が望ましいのかを一律にガイダンスに明記することは難しいですか?「一義的には研究責任者が判断し、その妥当性を含
めて倫理審査委員会で審査するもの」となるのでしょうか?
9