よむ、つかう、まなぶ。
資料1.医薬行政の最近の動き (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22281.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第1回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
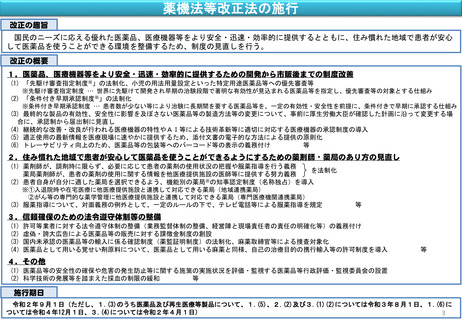
新型コロナウイルス感染症に係る治療薬・ワクチン・体外診断用医薬品の承認等の状況
(令和3年11月18日現在)
治療薬
販売名
一般名
製造販売業者
申請日、承認日等
対象者
備考
ベクルリー
レムデシビル
ギリアド・サ
イエンシズ
R2.5.4申請
R2.5.7承認(特例承認)
中等症Ⅰ~重症
抗ウイルス薬。RNAポリメラーゼ阻害薬であり、
エボラ出血熱の治療薬として開発された。
デカドロン
等
デキサメタゾン
日医工 等
R2.7.17診療の手引き掲載
重症感染症
ステロイド薬。重症感染症の治療薬として従来か
ら承認されていたステロイド薬。
オルミエント
バリシチニブ
日本イーライ
リリー
R2.12.25申請
R3.4.23承認
中等症Ⅱ~重症
抗炎症薬。関節リウマチ等の薬として承認されて
いたヤヌスキナーゼ(JAK)阻害剤。レムデシビル
と併用して用いる。
ロナプリーブ
カシリビマブ・
イムデビマブ
中外製薬
R3.6.29申請
R3.7.19承認(特例承認)
R3.11.5一部変更承認(特例承認)
軽症~中等症Ⅰ
中和抗体薬。重症化リスク因子を有する患者が対
象。2成分を混合して投与する。R3.11.5には発症
抑制を追加する一部変更を特例承認。
ゼビュディ
ソトロビマブ
GSK
R3.9.6申請
R3.9.27承認(特例承認)
軽症~中等症Ⅰ
中和抗体薬。重症化リスク因子を有する患者が対
象。変異の入りにくい領域に結合する1成分から
なる。
ワクチン
販売名
種類
製造販売業者
承認日
接種回数
保管条件
コミナティ筋注
mRNAワクチン
ファイザー
R2.12.18申請
R3.2.14承認(特例承認)
R3.11.11一部変更承認
(特例承認)
・2回接種(3週間間隔、筋注)
-対象年齢:12歳以上
・追加免疫(6ヶ月以上、筋注)
-対象年齢:18歳以上
-90~-60℃で製造から9ヶ月
-25~-15℃に移してから14日間
解凍後2~8℃で1ヶ月
COVID-19ワクチン
モデルナ筋注
mRNAワクチン
武田薬品工業
R3.3.5申請
R3.5.21承認(特例承認)
・2回接種(4週間間隔、筋注)
-対象年齢:12歳以上
-25~-15℃で製造から9ヶ月
バキスゼブリア筋
注
ウイルスベク
ターワクチン
アストラゼネ
カ
R3.2.5申請
R3.5.21承認(特例承認)
・2回接種(4~12週間間隔、筋注)
-対象年齢:18歳以上
2~8℃で製造から6ヶ月
体外診断用医薬品
核酸検査 34品目、抗原検査 31品目(抗原簡易キット 18品目、抗原定性検査 7品目、抗原定量検査 6品目)
24
(令和3年11月18日現在)
治療薬
販売名
一般名
製造販売業者
申請日、承認日等
対象者
備考
ベクルリー
レムデシビル
ギリアド・サ
イエンシズ
R2.5.4申請
R2.5.7承認(特例承認)
中等症Ⅰ~重症
抗ウイルス薬。RNAポリメラーゼ阻害薬であり、
エボラ出血熱の治療薬として開発された。
デカドロン
等
デキサメタゾン
日医工 等
R2.7.17診療の手引き掲載
重症感染症
ステロイド薬。重症感染症の治療薬として従来か
ら承認されていたステロイド薬。
オルミエント
バリシチニブ
日本イーライ
リリー
R2.12.25申請
R3.4.23承認
中等症Ⅱ~重症
抗炎症薬。関節リウマチ等の薬として承認されて
いたヤヌスキナーゼ(JAK)阻害剤。レムデシビル
と併用して用いる。
ロナプリーブ
カシリビマブ・
イムデビマブ
中外製薬
R3.6.29申請
R3.7.19承認(特例承認)
R3.11.5一部変更承認(特例承認)
軽症~中等症Ⅰ
中和抗体薬。重症化リスク因子を有する患者が対
象。2成分を混合して投与する。R3.11.5には発症
抑制を追加する一部変更を特例承認。
ゼビュディ
ソトロビマブ
GSK
R3.9.6申請
R3.9.27承認(特例承認)
軽症~中等症Ⅰ
中和抗体薬。重症化リスク因子を有する患者が対
象。変異の入りにくい領域に結合する1成分から
なる。
ワクチン
販売名
種類
製造販売業者
承認日
接種回数
保管条件
コミナティ筋注
mRNAワクチン
ファイザー
R2.12.18申請
R3.2.14承認(特例承認)
R3.11.11一部変更承認
(特例承認)
・2回接種(3週間間隔、筋注)
-対象年齢:12歳以上
・追加免疫(6ヶ月以上、筋注)
-対象年齢:18歳以上
-90~-60℃で製造から9ヶ月
-25~-15℃に移してから14日間
解凍後2~8℃で1ヶ月
COVID-19ワクチン
モデルナ筋注
mRNAワクチン
武田薬品工業
R3.3.5申請
R3.5.21承認(特例承認)
・2回接種(4週間間隔、筋注)
-対象年齢:12歳以上
-25~-15℃で製造から9ヶ月
バキスゼブリア筋
注
ウイルスベク
ターワクチン
アストラゼネ
カ
R3.2.5申請
R3.5.21承認(特例承認)
・2回接種(4~12週間間隔、筋注)
-対象年齢:18歳以上
2~8℃で製造から6ヶ月
体外診断用医薬品
核酸検査 34品目、抗原検査 31品目(抗原簡易キット 18品目、抗原定性検査 7品目、抗原定量検査 6品目)
24