よむ、つかう、まなぶ。
【参考資料7】希少疾病用医薬品等の指定に関する取扱いについて(薬生薬審発0831第7号) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
施行規則第 250 条第2項の規定により申請書に添付すべき資料が定めら
れているが、その具体的な内容は次のとおりであること。なお、このほか、
必要に応じて資料の提出を求めることがあること。
ア 対象者数に関する資料
当該医薬品等の用途に係る対象者数に関する客観的な統計資料
イ 医療上の必要性に関する資料
(ア)病因、症状等対象疾病に関する資料
(イ)類似の医薬品等の有無、治療方法の有無など医療の現状に関する資料
ウ 当該医薬品等を使用する理論的根拠となる資料
(ア)医薬品の場合
施行規則第 40 条第1項第1号に掲げる資料のうち申請時において入
手可能な資料の概要
(イ)医療機器・体外診断用医薬品の場合
施行規則第 114 条の 19 第1項第1号又は第2号に掲げる資料のうち
申請時において入手可能な資料の概要
(ウ)再生医療等製品の場合
施行規則第 137 条の 23 に掲げる資料のうち申請時において入手可能
な資料の概要
エ 開発計画
予定している試験項目、試験期間など開発計画の概要を説明する資料
オ
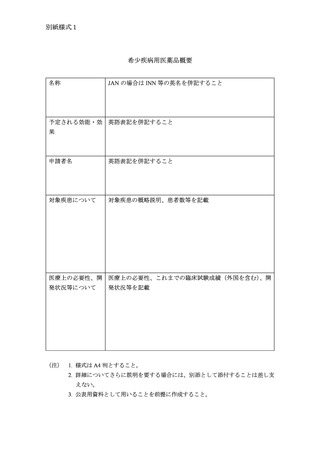
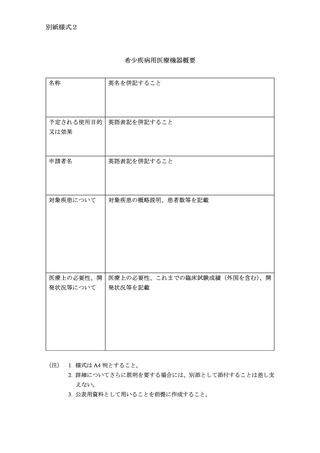
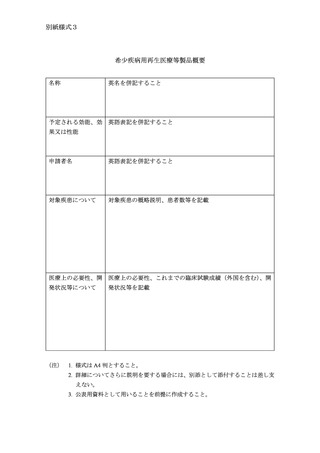
希少疾病用医薬品等の概要
部会説明用資料及び公表用資料として、別紙様式1、別紙様式2又は別
紙様式3に従って作成した概要(名称、予定される効能・効果、予定され
る使用目的又は効果、予定される効能、効果又は性能及び申請者名につい
ては英名又は英語表記を併記すること)
4 試験研究等の中止
法第 77 条の2第1項の規定による指定を受けた者(以下「指定者」という。)
は、当該指定に係る希少疾病用医薬品等の試験研究、製造販売又は製造を中止
しようとするときは、法第 77 条の5の規定に基づき、速やかに厚生労働大臣
に届け出ること。
なお、中止の届出は、施行規則様式第 108 による届書を提出することにより
行うこと。
5 指定の取消
法第 77 条の5の規定による中止の届出があったときは、法第 77 条の6第
れているが、その具体的な内容は次のとおりであること。なお、このほか、
必要に応じて資料の提出を求めることがあること。
ア 対象者数に関する資料
当該医薬品等の用途に係る対象者数に関する客観的な統計資料
イ 医療上の必要性に関する資料
(ア)病因、症状等対象疾病に関する資料
(イ)類似の医薬品等の有無、治療方法の有無など医療の現状に関する資料
ウ 当該医薬品等を使用する理論的根拠となる資料
(ア)医薬品の場合
施行規則第 40 条第1項第1号に掲げる資料のうち申請時において入
手可能な資料の概要
(イ)医療機器・体外診断用医薬品の場合
施行規則第 114 条の 19 第1項第1号又は第2号に掲げる資料のうち
申請時において入手可能な資料の概要
(ウ)再生医療等製品の場合
施行規則第 137 条の 23 に掲げる資料のうち申請時において入手可能
な資料の概要
エ 開発計画
予定している試験項目、試験期間など開発計画の概要を説明する資料
オ
希少疾病用医薬品等の概要
部会説明用資料及び公表用資料として、別紙様式1、別紙様式2又は別
紙様式3に従って作成した概要(名称、予定される効能・効果、予定され
る使用目的又は効果、予定される効能、効果又は性能及び申請者名につい
ては英名又は英語表記を併記すること)
4 試験研究等の中止
法第 77 条の2第1項の規定による指定を受けた者(以下「指定者」という。)
は、当該指定に係る希少疾病用医薬品等の試験研究、製造販売又は製造を中止
しようとするときは、法第 77 条の5の規定に基づき、速やかに厚生労働大臣
に届け出ること。
なお、中止の届出は、施行規則様式第 108 による届書を提出することにより
行うこと。
5 指定の取消
法第 77 条の5の規定による中止の届出があったときは、法第 77 条の6第