よむ、つかう、まなぶ。
資料2-4 市販後安全性情報に関する報告(製造販売業者の公表資料)[1.6MB] (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34889.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第6回 8/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
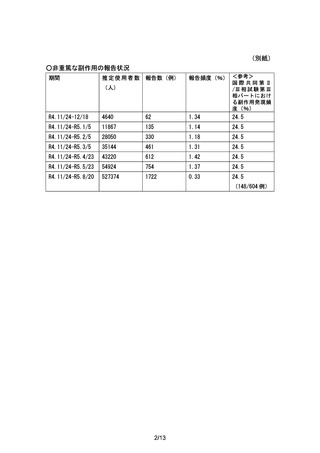
<重要な不足情報>【医薬品リスク管理計画書からの抜粋】2023 年 8 月作成版
中等度以上の肝機能障害患者での安全性
重要な不足情報とした理由:
中等度以上の肝機能障害患者での投与経験はなく、これらの患者に投与した際に本剤の血中濃度が上昇
する可能性があり、それに伴い安全性上の懸念が生じる可能性は否定できないことから、中等度以上の肝
機能障害患者での安全性を設定した。
医薬品安全性監視活動の内容:
【内容】
・ 通常の医薬品安全性監視活動
・ 追加の医薬品安全性監視活動として、
「肝機能障害を有する被験者を対象とした臨床薬理試験※」を
実施する。
リスク最小化活動の内容:
【内容】
・ 通常のリスク最小化活動として、添付文書の「9.3 肝機能障害患者」の項及び「患者向医薬品ガイド」
に記載して注意喚起を行う。
※肝機能障害を有する被験者を対象とした臨床薬理試験
【目的】肝機能障害患者における薬物動態を評価する
【実施計画】
実施国:米国
実施期間: 2022 年 7 月~2022 年 11 月
目標症例数:肝機能正常健康成人、軽度肝機能障害患者及び中等度肝機能障害患者;各 8 例
実施方法:オープンラベル、非ランダム化、並行群間比較試験
観察期間:本剤の投与開始から 21 日間
報告書作成予定:2023 年 12 月
【添付文書からの抜粋】2023 年 7 月改訂[第 5 版:国購入品(凸錠)、6 版:一般流通品(薬価収載品 )共通]
9.特定の背景を有する患者に関する注意
(略)
9.3 肝機能障害患者
肝機能障害患者を対象とした臨床試験は実施していない。
9.3.1 肝機能障害のある患者で、コルヒチンを投与中の患者
投与しないこと。コルヒチンの血中濃度が上昇するおそれがある。[2.3、10.2 参照]
9.3.2 重度の肝機能障害患者(コルヒチンを投与中の患者を除く)
投与は推奨されない。本剤の血中濃度が著しく上昇するおそれがある。
9.3.3 中等度の肝機能障害患者(コルヒチンを投与中の患者を除く)
本剤の血中濃度が上昇するおそれがある。
肝機能障害を有する被験者を対象とした臨床薬理試験を実施中です。
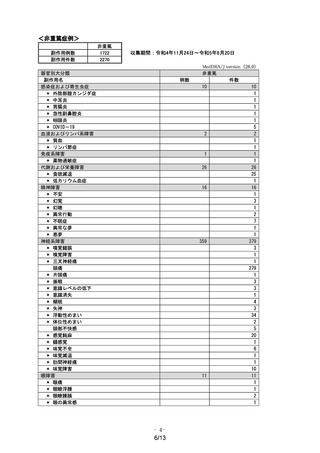
市販後において、中等度の肝機能障害のある患者へ本剤を投与した症例が 5 例集積されました
が、副作用等は発現していません。
XCV-X-13(C1)
令和5年8月作成
- 1113/13
中等度以上の肝機能障害患者での安全性
重要な不足情報とした理由:
中等度以上の肝機能障害患者での投与経験はなく、これらの患者に投与した際に本剤の血中濃度が上昇
する可能性があり、それに伴い安全性上の懸念が生じる可能性は否定できないことから、中等度以上の肝
機能障害患者での安全性を設定した。
医薬品安全性監視活動の内容:
【内容】
・ 通常の医薬品安全性監視活動
・ 追加の医薬品安全性監視活動として、
「肝機能障害を有する被験者を対象とした臨床薬理試験※」を
実施する。
リスク最小化活動の内容:
【内容】
・ 通常のリスク最小化活動として、添付文書の「9.3 肝機能障害患者」の項及び「患者向医薬品ガイド」
に記載して注意喚起を行う。
※肝機能障害を有する被験者を対象とした臨床薬理試験
【目的】肝機能障害患者における薬物動態を評価する
【実施計画】
実施国:米国
実施期間: 2022 年 7 月~2022 年 11 月
目標症例数:肝機能正常健康成人、軽度肝機能障害患者及び中等度肝機能障害患者;各 8 例
実施方法:オープンラベル、非ランダム化、並行群間比較試験
観察期間:本剤の投与開始から 21 日間
報告書作成予定:2023 年 12 月
【添付文書からの抜粋】2023 年 7 月改訂[第 5 版:国購入品(凸錠)、6 版:一般流通品(薬価収載品 )共通]
9.特定の背景を有する患者に関する注意
(略)
9.3 肝機能障害患者
肝機能障害患者を対象とした臨床試験は実施していない。
9.3.1 肝機能障害のある患者で、コルヒチンを投与中の患者
投与しないこと。コルヒチンの血中濃度が上昇するおそれがある。[2.3、10.2 参照]
9.3.2 重度の肝機能障害患者(コルヒチンを投与中の患者を除く)
投与は推奨されない。本剤の血中濃度が著しく上昇するおそれがある。
9.3.3 中等度の肝機能障害患者(コルヒチンを投与中の患者を除く)
本剤の血中濃度が上昇するおそれがある。
肝機能障害を有する被験者を対象とした臨床薬理試験を実施中です。
市販後において、中等度の肝機能障害のある患者へ本剤を投与した症例が 5 例集積されました
が、副作用等は発現していません。
XCV-X-13(C1)
令和5年8月作成
- 1113/13