よむ、つかう、まなぶ。
【資料1】医薬品の製造方法等に係る薬事審査等のあり方について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35743.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第4回 10/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
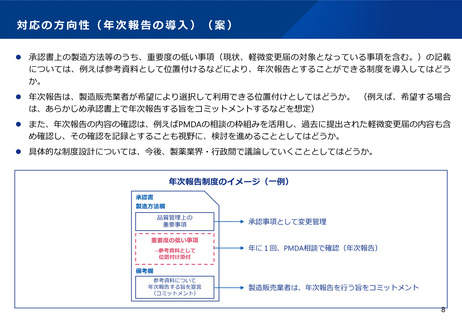
対応の方向性(承認書の記載事項のあり方について)(案)
⚫ 中等度変更事項や年次報告の導入に伴い、承認書の製造方法等の記載事項についても、欧米との制度の違いも含め
て検討していく必要がある。
⚫ 製造方法等の記載事項については、従来、「改正薬事法に基づく医薬品等の製造販売承認申請書記載事項に関する
指針について」(平成17年2月10日付け薬食審査発第0210001号厚生労働省医薬食品局審査管理課長通知)におい
て例示されてきた。本通知は、平成17年当時は日本の実情に合った優れた内容であったものの、近年では、欧米で
の記載方法とは必ずしも一致していないこともあり、例えば以下のような事項を含めて、様々な課題が発生してい
る。
•
•
•
•
製造工程のパラメータについて、目標値/設定値として一点で記載を通常求めていること(海外では幅記載が通常)。
製造工程のうち、重要工程を特定し、記載させること。
軽微変更に該当する項目を、あらかじめ特定し、記載させること。
製造所間の製造物の移動について製造所ごとに連番を付すことにより特定する必要があること(保管製造所との移動を柔軟に行い
にくい)
⚫ こうした課題については、これまで、以下のような議論の場で、製薬業界と行政との間で議論を行ってきた。
•
•
承認書記載内容に関する検討の統一化会議(厚労省、PMDA、製薬業界)
AMED研究費医薬品等規制調和・評価研究事業「先進的製造・品質管理及び評価手法を反映した医薬品のライフサイクルマネジメ
ントに関する研究」(厚労省・国衛研、PMDA、製薬業界)
⚫ このため、中等度変更事項や年次報告の導入に伴う、承認書の製造方法等の記載事項のあり方については、2月10
日付け通知を全面改正することを含め、試行的な実施の方法にはとらわれず、国際的に整合したリスクベースの変
更管理が実現できるよう、引き続き製薬業界・行政間で議論を進めることとしてはどうか。
10
⚫ 中等度変更事項や年次報告の導入に伴い、承認書の製造方法等の記載事項についても、欧米との制度の違いも含め
て検討していく必要がある。
⚫ 製造方法等の記載事項については、従来、「改正薬事法に基づく医薬品等の製造販売承認申請書記載事項に関する
指針について」(平成17年2月10日付け薬食審査発第0210001号厚生労働省医薬食品局審査管理課長通知)におい
て例示されてきた。本通知は、平成17年当時は日本の実情に合った優れた内容であったものの、近年では、欧米で
の記載方法とは必ずしも一致していないこともあり、例えば以下のような事項を含めて、様々な課題が発生してい
る。
•
•
•
•
製造工程のパラメータについて、目標値/設定値として一点で記載を通常求めていること(海外では幅記載が通常)。
製造工程のうち、重要工程を特定し、記載させること。
軽微変更に該当する項目を、あらかじめ特定し、記載させること。
製造所間の製造物の移動について製造所ごとに連番を付すことにより特定する必要があること(保管製造所との移動を柔軟に行い
にくい)
⚫ こうした課題については、これまで、以下のような議論の場で、製薬業界と行政との間で議論を行ってきた。
•
•
承認書記載内容に関する検討の統一化会議(厚労省、PMDA、製薬業界)
AMED研究費医薬品等規制調和・評価研究事業「先進的製造・品質管理及び評価手法を反映した医薬品のライフサイクルマネジメ
ントに関する研究」(厚労省・国衛研、PMDA、製薬業界)
⚫ このため、中等度変更事項や年次報告の導入に伴う、承認書の製造方法等の記載事項のあり方については、2月10
日付け通知を全面改正することを含め、試行的な実施の方法にはとらわれず、国際的に整合したリスクベースの変
更管理が実現できるよう、引き続き製薬業界・行政間で議論を進めることとしてはどうか。
10