よむ、つかう、まなぶ。
【資料1】医薬品の製造方法等に係る薬事審査等のあり方について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35743.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第4回 10/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
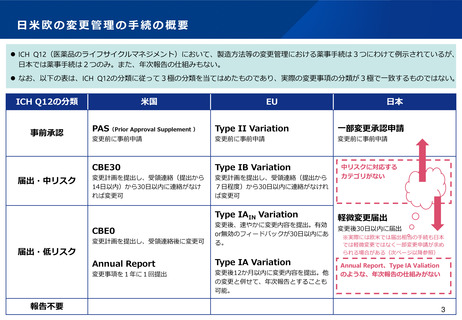
日米欧の変更管理の手続の概要
⚫ ICH Q12(医薬品のライフサイクルマネジメント)において、製造方法等の変更管理における薬事手続は3つにわけて例示されているが、
日本では薬事手続は2つのみ。また、年次報告の仕組みもない。
⚫ なお、以下の表は、ICH Q12の分類に従って3極の分類を当てはめたものであり、実際の変更事項の分類が3極で一致するものではない。
ICH Q12の分類
事前承認
届出・中リスク
米国
EU
PAS(Prior Approval Supplement )
Type II Variation
一部変更承認申請
変更前に事前申請
変更前に事前申請
変更前に事前申請
CBE30
Type IB Variation
変更計画を提出し、受領連絡(提出から
14日以内)から30日以内に連絡がなけ
れば変更可
変更計画を提出し、受領連絡(提出から
7日程度)から30日以内に連絡がなけれ
ば変更可
中リスクに対応する
カテゴリがない
Type IAIN Variation
変更計画を提出し、受領連絡後に変更可
変更後、速やかに変更内容を提出。有効
or無効のフィードバックが30日以内にあ
る。
Annual Report
Type IA Variation
変更事項を1年に1回提出
変更後12か月以内に変更内容を提出。他
の変更と併せて、年次報告とすることも
可能。
CBE0
届出・低リスク
報告不要
日本
軽微変更届出
変更後30日以内に届出
※実際には欧米では届出相当の手続も日本
では軽微変更ではなく一部変更申請が求め
られる場合がある(次ページ以降参照)
Annual Report、Type IA Valiation
のような、年次報告の仕組みがない
3
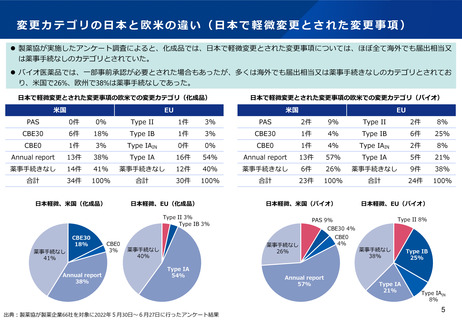
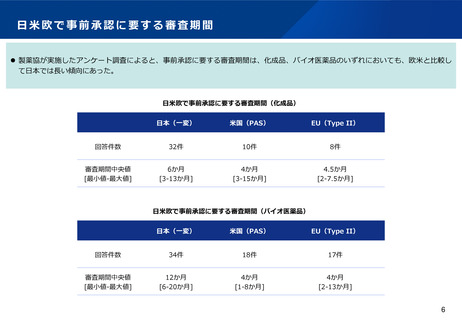
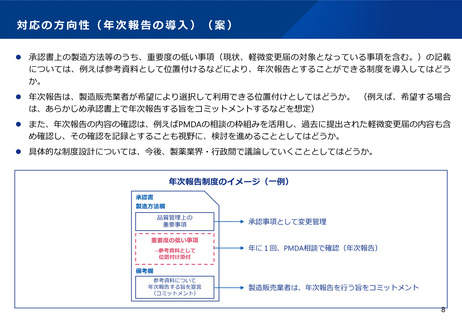
⚫ ICH Q12(医薬品のライフサイクルマネジメント)において、製造方法等の変更管理における薬事手続は3つにわけて例示されているが、
日本では薬事手続は2つのみ。また、年次報告の仕組みもない。
⚫ なお、以下の表は、ICH Q12の分類に従って3極の分類を当てはめたものであり、実際の変更事項の分類が3極で一致するものではない。
ICH Q12の分類
事前承認
届出・中リスク
米国
EU
PAS(Prior Approval Supplement )
Type II Variation
一部変更承認申請
変更前に事前申請
変更前に事前申請
変更前に事前申請
CBE30
Type IB Variation
変更計画を提出し、受領連絡(提出から
14日以内)から30日以内に連絡がなけ
れば変更可
変更計画を提出し、受領連絡(提出から
7日程度)から30日以内に連絡がなけれ
ば変更可
中リスクに対応する
カテゴリがない
Type IAIN Variation
変更計画を提出し、受領連絡後に変更可
変更後、速やかに変更内容を提出。有効
or無効のフィードバックが30日以内にあ
る。
Annual Report
Type IA Variation
変更事項を1年に1回提出
変更後12か月以内に変更内容を提出。他
の変更と併せて、年次報告とすることも
可能。
CBE0
届出・低リスク
報告不要
日本
軽微変更届出
変更後30日以内に届出
※実際には欧米では届出相当の手続も日本
では軽微変更ではなく一部変更申請が求め
られる場合がある(次ページ以降参照)
Annual Report、Type IA Valiation
のような、年次報告の仕組みがない
3